Endokrynol. Ped. 11/2012;2(39):51-60
DOI: 10.18544/EP-01.11.02.1382
Pula wolnych aminokwasów w organizmie człowieka
III Katedra Pediatrii Klinika Endokrynologii i Neurologii Dziecięcej, Uniwersytet Medyczny, Lublin
Słowa kluczowe: przemiana białkowo-aminokwasowa
Streszczenie
Aminokwasy są elementarnymi cegiełkami białka zarówno enzymatycznego, jak i nieenzymatycznego, są również prekursorami wielu niezbędnych dla życia substancji, takich jak: hormony (tyroksyna, trijodotyronina, adrenalina), neuroprzekaźniki (serotonina, acetylocholina, noradrenalina), porfiryny, zasady purynowe, pirymidynowe. Całkowita pula wolnych aminokwasów ustroju wynosi 120 g, co stanowi zaledwie 1% całkowitej puli białek i 30% dobowego obrotu białkowego ocenianego blisko na 400–800 g/dobę. W całkowitej puli 8 aminokwasów niezbędnych stanowi jedynie 8,4%, natomiast glutamina, kwas glutaminowy, alanina i glicyna stanowią około 79%. Białko odgrywa ogromną rolę w każdym żywym organizmie, o czym świadczy próba definiowania życia jako „formy istnienia białka”. Wolne aminokwasy surowicy krwi są w stanie równowagi dynamicznej, która jest konsekwencją ich: podaży dietetycznej, absorpcji jelitowej, uwalniania z endogennych zasobów białkowych, wychwytu przez wątrobę i inne tkanki, endogennej syntezy i katabolizmu
Pula wolnych aminokwasów w organizmie
Badania mikroorganizmów w skamienielinach udowodniły obecność aminokwasów przed trzema miliardami lat. Analiza chromatograficzna wykazuje ich obecność w organicznych składnikach meteorytów. Śladowe ilości glicyny i alaniny zostały wykryte w próbkach pochodzących z Księżyca [1].
Zdecydowana większość aminokwasów może być całkowicie syntetyzowana w organizmie człowieka, są to aminokwasy endogenne [2,3]. Niektóre z nich organizm musi jednak otrzymywać w gotowej formie, nie będąc zdolnym do syntezy ich szkieletu węglowego. Aminokwasy te nazywamy egzogennymi, podstawowymi lub niezbędnymi [2–4].
Do aminokwasów endogennych zaliczamy: alaninę, asparaginę, kwas asparaginowy, glutaminę, kwas glutaminowy, glicynę, prolinę, serynę, tyrozynę i cystynę. Aminokwasy endogenne powstają w organizmie z odpowiadających im ketokwasów. W jednym z trzech szlaków metabolicznych z alfa-ketoglutaranu powstaje: kwas glutaminowy, glutamina, prolina i u młodych osobników arginina, z pirogroninanu: alanina, seryna, cystyna i glicyna, a ze szczawiooctanu: kwas asparaginowy i asparagina.
Tyrozyna i cystyna powstają w wyniku przemian aminokwasów egzogennych. Tyrozyna na drodze hydroksylacji z fenyloalaniny, a cystyna
z metioniny.
Do grupy aminokwasów egzogennych należą zaś: lizyna, tryptofan, fenyloalanina, treonina, walina, leucyna, isoleucyna i metionina [5–9]. Arginina i histydyna [10] określane są jako aminokwasy półniezbędne ze względu na niedostateczną ich syntezę w rosnącym organizmie.
W okresie noworodkowym i niemowlęcym cysteina i histydyna są aminokwasami egzogennymi [11], zaś arginina i histydyna są aminokwasami egzogennymi dla chorych z przewlekłą niewydolnością nerek. Badania ostatnich lat wykazały, że w ustroju człowieka syntetyzowane mogą być również aminokwasy egzogenne (z wyjątkiem lizyny i treoniny) po dostarczeniu mu odpowiednich ketokwasów.
Aminokwasy są elementarnymi cegiełkami białka, zarówno enzymatycznego, jak i nieenzymatycznego, są również prekursorami wielu niezbędnych dla życia substancji, takich jak: hormony (tyroksyna, trijodotyronina, adrenalina), neuroprzekaźniki (serotonina, acetylocholina, noradrenalina), porfiryny, zasady purynowe, pirymidynowe. Aminokwasy egzogenne są ponadto niezbędne dla prawidłowej funkcji ośrodkowego układu nerwowego (walina), wątroby (leucyna, metionina, cysteina i cystyna), układu krwiotwórczego (histydyna, fenyloalanina, tyroksyna), dla syntezy kwasu nikotynowego (tryptofan) i barwnika oczu oraz dla prawidłowego wzrostu organizmu (arginina). Ponadto aminokwasy mogą ulec przekształceniu do węglowodanów, tłuszczy lub spaleniu do dwutlenku węgla i wody, dostarczając organizmowi związków wysokoenergetycznych.
Całkowita pula wolnych aminokwasów ustroju wynosi 120 g, co stanowi zaledwie 1% całkowitej puli białek i 30% dobowego obrotu białkowego ocenianego blisko na 400–800 g/dobę [12,13].
W 1913 r. Van Slyke i Mayer [14] stwierdzili, że tkanki ustroju mają zdolność gromadzenia wolnych aminokwasów. Każda tkanka posiada własną pulę wolnych aminokwasów. Stężenia wolnych aminokwasów w ustroju są bardzo niskie (0,01 M) w porównaniu ze stężeniem aminokwasów w puli aminokwasów związanych, tzn. wchodzących w skład białka (2,0 M). Dlatego też nawet bardzo niskie zmiany zawartości białka w organizmie, spowodowane wzrostem lub obniżeniem syntezy białka, mogą wywierać znaczny wpływ na poziom poszczególnych wolnych aminokwasów [10].
Pula wolnych aminokwasów nazywana jest także pulą metaboliczną. Zawiera ona aminokwasy w przestrzeni wewnątrz- i zewnątrzkomórkowej [10,15]. Tkanki zawierają więcej wolnych aminokwasów niż osocze, przy czym najwięcej (50–80%) występuje w mięśniach szkieletowych [16].
W całkowitej puli 8 aminokwasów niezbędnych stanowi jedynie 8,4%, natomiast glutamina, kwas glutaminowy, alanina i glicyna stanowią około 79% [12,16,17]. Stężenie większości wolnych aminokwasów w mięśniach jest znacznie wyższe niż w osoczu.
Proporcja mięśni do ciężaru ciała człowieka ulega zmianie w różnych okresach życia, i tak – po urodzeniu stanowią one 21% ciężaru ciała, u niemowląt 18%, u młodzieży 36%, u dorosłych 45%, w okresie starzenia się 27%, zmianie ulega więc także całkowita zawartość wewnątrzkomórkowych aminokwasów [18]. Wewnątrzkomórkowe wzorce aminokwasów są odtwarzalne u poszczególnych osobników, co sugeruje, że stężenia poszczególnych aminokwasów w komórce są precyzyjnie regulowane [12].
Wątrobowa pula wolnych aminokwasów stanowi 10%, a nerkowa 4% ogółu wolnych aminokwasów. Pula wolnych aminokwasów osocza szacowana jest na 1–6% całkowitej ilości wolnych aminokwasów w ustroju. Stężenie wolnych aminokwasów w poszczególnych składnikach krwi człowieka znacznie się różni, w leukocytach jest ono 4–60 razy wyższe niż w osoczu, podobnie w płytkach krwi, jedynie argininy jest niższe. Stężenie wolnych aminokwasów osocza regulowane jest przez zawartość białka (podaż białka) w pożywieniu, procesy transportu, procesy wydalania aminokwasów z ustroju [10].
W organizmie zdrowego człowieka stężenie aminokwasów tej puli w stanie podstawowym jest stałe i uwarunkowane genetycznie [19,20],
a w okresie międzyabsorbcyjnym nie zależy od diety [19–21].
Białko jako pula aminokwasów związanych
Białko stanowi tzw. pulę aminokwasów związanych, cechuje je olbrzymia różnorodność właściwości i funkcji. Wyróżniamy białka szybko metabolizowane, których okres półtrwania w ustroju wynosi minuty, a nawet sekundy lub ułamki sekund. Są to białkowe mediatory tkankowe i hormony białkowe. Białka, których okres półtrwania wynosi wiele godzin lub nawet kilkanaście dni, są metabolizowane z prędkością zbliżoną do przeciętnej prędkości ogólnoustrojowej, wynoszącej 80 dni.
Do białek wolno lub bardzo wolno metabolizowanych należą białka odpornościowe klasy gamma-globulin, białka budujące skórę, włókna kolagenu ścięgien czy mięśni. Ich okres półtrwania wynosi wiele tygodni, miesięcy, czy nawet wiele lat.
Większość białek w ustroju znajduje się w komórkach tkanek i narządów, drugą przestrzenią zawierającą znaczne ilości białka jest osocze, mniejsze ilości białka zawiera chłonka, inne płyny ustrojowe, np. płyny tkankowe, płyn mózgowo-rdzeniowy, zawierają niewielkie ilości białka stanowiące tylko nikły ułamek całości białek ustroju [22].
Organizm traci dziennie około 1/5, 1/6 puli metabolizowanego białka i taka właśnie ilość stanowi minimum wymagające uzupełnienia białkiem pokarmowym. Podobnie jak i inne składniki ciała, białka nie występują w stanie statycznym, ale podlegają ciągłemu przepływowi, odzwierciedlającemu równowagę pomiędzy syntezą a rozpadem [10,23].
Białka żywych organizmów są stale odnawiane przez wymianę białka, nieprzerwany proces degradacji, a następnie syntezy z wolnych aminokwasów. Szybkość degradacji znacznie różni się między białkami, zależy także od różnych stanów fizjologicznych. Szybkość degradacji odpowiada ich fizjologicznemu znaczeniu.
Wolne aminokwasy tkanek wchodzą w szereg reakcji, które można podzielić na trzy podstawowe kategorie [20].
1. Część wolnych aminokwasów bierze dział w biosyntezie białek i biologicznie czynnych peptydów. Po degradacji aminokwasy te mogą powracać w różnym czasie do wspólnej puli wolnych aminokwasów i ulegać dalszym przemianom.
2. Niektóre wolne aminokwasy są zużywane do syntezy związków niebiałkowych, jak zasady purynowe, kreatyna, aminy biogenne. Produkty degradacji tych związków nie wracają już do puli wolnych aminokwasów.
3. Pozostałe wolne aminokwasy ulegają reakcjom katabolicznym.
W pewnym uproszczeniu można przyjąć następujące wykorzystanie aminokwasów dostarczonych z pokarmem dorosłym osobnikom [20]:
1) 1/3 puli wolnych aminokwasów ulega spaleniu i jest wydalona jako CO2,
2) 1/3 wykorzystana jest w syntezie białek,
3) 1/3 włączona jest do innych szlaków metabolicznych.
Aminokwasy po uwolnieniu z cząsteczek białek (ryc. 1) w wyniku trawienia są wchłaniane w jelicie i przechodzą przez żyłę wrotną do wątroby, wchodząc w skład puli metabolicznej aminokwasów, która powstaje z aminokwasów dostarczanych z pożywienia oraz z wolnych aminokwasów komórkowych [10].
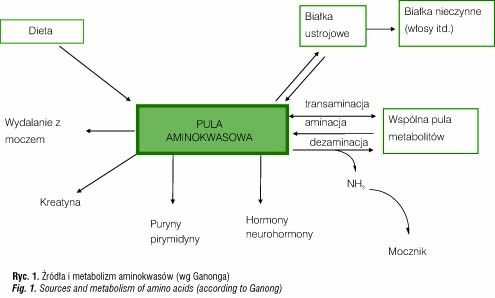
Aminokwasy jako nierozpuszczalne w tłuszczach przechodzą przez błony biologiczne zależnie od transportu czynnego przy pomocy specyficznych układów przenoszących [24]. Christensen opisał kilka układów transportowych o różnych powinowactwach do rozmaitych aminokwasów [25]:
• Układ przenoszący aminokwasy obojętne I: alaninę, serynę, tyrozynę, fenyloalninę, asparaginę, glutaminę, leucynę, walinę, isoleucynę, tryptofan.
• Układ przenoszący aminokwasy obojętne II: metioninę, leucynę, walinę, isoleucynę.
• Układ przenoszący aminokwasy obojętne III: tryptofan.
• Układ przenoszący iminokwasy: prolinę, hydroksyprolinę i glicynę.
• Układ przenoszący aminokwasy kwaśne: kwas glutaminowy i asparaginowy.
• Układ przenoszący aminokwasy zasadowe: lizynę, argininę, ornitynę i cystynę.
Stężenie wolnych aminokwasów w osoczu w stanie pełnego zdrowia wykazuje względnie małe między- i wewnątrzosobnicze zmienności [9]. Utrzymanie stanu stacjonarnego stężeń aminokwasów w osoczu jest zależne od równowagi między uwalnianiem aminokwasów z endogennych zasobów białek a wykorzystaniem ich przez różnorodne tkanki ustroju.
Mięśnie, główny rezerwuar białek ustroju, wytwarzają ponad 50% całkowitej puli aminokwasów, podczas gdy wątroba jest miejscem działania enzymów cyklu mocznikowego niezbędnego do usuwania azotu. Te dwa organy odgrywają więc decydującą rolą w określeniu poziomu krążących aminokwasów i w ich obrocie [26].
Międzynarządowa wymiana aminokwasów
W stanie postabsorbcyjnym (ryc. 2), to jest po 12–14 godzinach całonocnej głodówki mięśnie znajdują się w stanie ujemnej równowagi azotowej, uwalniając wolne aminokwasy [27–29].
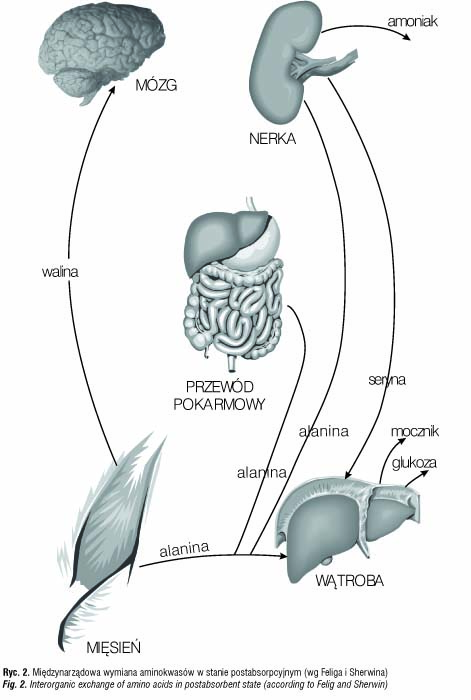
Wzorzec tego uwalniania jest bardzo charakterystyczny, gdyż wartości alaniny i glutaminy przewyższają wartości wszystkich innych aminokwasów i stanowią: dla alaniny 30%, a dla alaniny z glutaminą 50% całkowitego azotu alfa-aminowego [27,28,30–32]. W mięśniu sercowym produkcja alaniny wykazuje nawet większą dominację niż w mięśniach szkieletowych, stanowiąc ponad 80% uwalnianych aminokwasów [30]. Alanina stanowi nie więcej niż 7–10% aminokwasów obecnych w białkach mięśni szkieletowych i mięśnia sercowego, nie stwierdzono również obecności w mięśniach specyficznego polialaninowego białka. Dominacja alaniny wynika bowiem z faktu, iż jest ona syntetyzowana w mięśniach de novo poprzez transaminację pirogronianu [31,33]. Około 60% pirogronianu zaangażowanego w syntezę alaniny w tkance mięśniowej tworzy się przez glikolizę, część natomiast może być otrzymana z aminokwasów [34].
Aminokwasy rozgałęzione: walina, leucyna i izoleucyna dostarczają grup aminowych dla syntezy alaniny. Donorem grup aminowych jest także asparaginian (zwłaszcza podczas intensywnego wysiłku fizycznego), a także w niewielkim procencie: glutaminian, cystyna, metionina, seryna, treonina, glicyna i histydyna [31,35–38]. Poza alaniną i glutaminą w znacznie mniejszej ilości uwalnianie są z mięśni inne aminokwasy. W kolejności według wielkości wypływu są to: glicyna, lizyna, prolina, treonina, histydyna, leucyna, walina, arginina, fenyloalanina, tyrozyna, metionina i isoleucyna [24,26].
W odróżnieniu od metabolizmu obserwowanego dla większości aminokwasów w tkance mięśniowej wykazano niewielki, ale stały wychwyt przez mięśnie seryny i cystyny [27,31] oraz glutaminianu [32].
Komplementarny do ujemnej równowagi aminokwasów w tkance mięśniowej jest stały ich wychwyt przez narządy trzewne. Podobnie jak w wypadku obwodowej produkcji alanina i glutamina dominują w wychwycie aminokwasów przez tkanki trzewne [31,39]. W obszarze trzewnym wątroba jest miejscem wychwytu alaniny [31]. Alanina stanowi około 50% ilości aminokwasów wychwytywanych przez wątrobę [31], a wraz z glicyną, treoniną i seryną 85% [40].
Glutamina zaś jest wychwytywana głównie przez jelito [26], a następnie częściowo oddawana do wątroby jako alanina (24,26,41,42). Blisko 50% ogólnego wychwytu wątrobowego alaniny stanowi jej produkcja jelitowa.
Do pozostałych aminokwasów według kolejności wpływu należą: lizyna, histydyna, tyrozyna, arginina, cystyna, metionina, fenyloalanina, prolina [31]. Znaczącymi wyjątkami są jednak aminokwasy rozgałęzione: walina, leucyna i isoleucyna, których wychwytu nie obserwuje się [31,39], natomiast obserwuje się nawet produkcję w narządach trzewnych [31,43]. Brak wątrobowego wychwytu tych aminokwasów dowodzi, że to tkanki pozawątrobowe, a nie wątroba są głównym miejscem ich katabolizmu [26].
Nerka jest głównym miejscem usuwania glutaminy, gdzie dostarcza ona azotu do amoniakogenezy [24,42,44], zaś jej szkielet węglowy używany jest do produkcji glukozy w procesie glukoneogenezy lub zostaje utleniony do dwutlenku węgla [26,42,44]. Równowagę aminokwasów w nerce stanowi wychwyt glutaminy, proliny i glicyny oraz produkcja seryny i alaniny [26]. Nerka jest głównym źródłem uwalniania tego aminokwasu do krążenia układowego, który następnie jest pobierany przez wątrobę i mięśnie. Udział nerki w całkowitym uwalnianiu alaniny (10–20umol/l) jest dużo mniejszy niż jej uwalnianie z mięśni (100umol/l) [21,29].
Wychwyt aminokwasów rozgałęzionych, zwłaszcza waliny, przez tkankę mózgową przewyższa wartości dla wszystkich innych aminokwasów, ponieważ znaczące ilości waliny, leucyny i izoleucyny są uwalniane z mięśni [21,29], ale nie pochłaniane przez wątrobę (31,39,43), co dowodzi, że mózg stanowi ważne miejsce wykorzystania tych aminokwasów.
Obserwacje równowagi aminokwasów w mięśniach, wątrobie, żołądku, jelitach, nerce i mózgu zdrowego człowieka wyraźnie wykazują kluczową rolę alaniny i glutaminy w całkowitym przepływie aminokwasów między tkankami, udowadniając uniwersalność alaniny jako nośnika transportu azotu i jako końcowego produktu katabolizmu azotu u rozmaitych gatunków [26].
Spożycia białka powoduje wzrost poziomów aminokwasów w krążeniu [21,45–56]. Aminokwasy powstałe w wyniku hydrolizy spożytego białka są wychwytywane głównie przez wątrobę (ryc. 3).
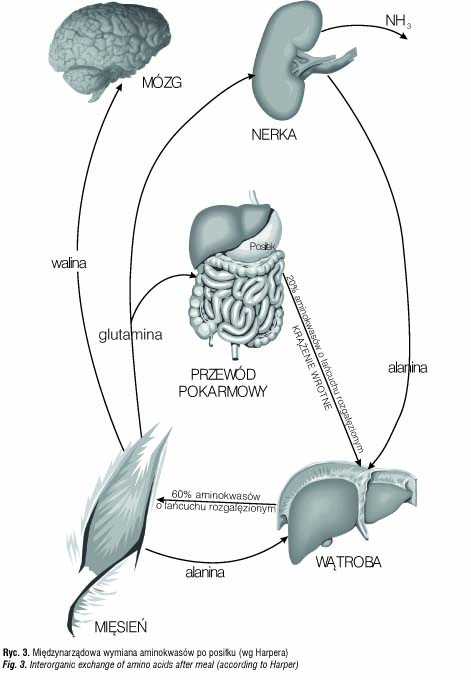
Wypływ aminokwasów z jelita do żyły wrotnej po spożyciu białka charakteryzuje się dominacją alaniny oraz nieobecnością glutaminianu i asparaginianu (mimo faktu, że ten drugi stanowi 20–30% składu spożytych białek). Wychwyt alaniny przez wątrobę przewyższa jej uwalnianie z jelita, co wskazuje na trwającą produkcję alaniny w tkankach obwodowych podczas okresu absorpcyjnego [26].
Jedynie aminokwasy o łańcuchach rozgałęzionych po przejściu przez wątrobę są wybiórczo wychwytywane przez mięśnie szkieletowe [42,44].
Pobieranie aminokwasów rozgałęzionych przez wątrobę jest nieznaczne. Oprócz mięśni szkieletowych istotna degradacja waliny, leucyny i isoleucyny zachodzi natomiast w nerkach, tkance tłuszczowej i w mózgu [44,57,58].
Około 20% aminokwasów wchłoniętych z przewodu pokarmowego do żyły wrotnej przechodzi przez wątrobę do krążenia ogólnego w stanie niezmienionym [58]. Dominują w tym aminokwasy o łańcuchu rozgałęzionym, które stanowią 60% aminokwasów wchodzących do krążenia ogólnego, przy niespełna 20% ich zawartości w posiłku białkowym. Po posiłku białkowym ich stężenie wzrasta do 200% w surowicy i stan taki utrzymuje się nawet do 8 godzin [59].
Mięśnie szkieletowe pobierają z surowicy krwi głównie aminokwasy rozgałęzione, które stanowią 50% aminokwasów wychwytywanych w pierwszej godzinie i 90–100% w drugiej i w trzeciej godzinie po posiłku białkowym [59], po którym występuje nadal uwalnianie z mięśni szkieletowych alaniny i glutaminy, jednakże w zredukowanych do 60% ilościach [60].
Walina, leucyna, isoleucyna są wykorzystywane w mięśniach do syntezy białka bądź katabolizowane, a ich azot zostaje wykorzystany do produkcji alaniny i glutaminy, dlatego też poziom alaniny wzrasta nawet trzykrotnie [44,57] w surowicy krwi po posiłku białkowym. Kiedy aminokwasy są wstrzykiwane dożylnie, a nie spożywane i omijają w ten sposób jelito i wątrobę, to ważność alaniny w katabolizmie aminokwasów i wykorzystaniu azotu jest również widoczna [61].
Aminokwasy w przeciwieństwie do węglowodanów i tłuszczy, nie mają wspólnych dróg metabolicznych. W związku z tym, że wszystkie, z wyjątkiem proliny i hydroksyproliny, zawierają takie same trzy grupy przy atomie węgla, tzn. grupę aminową, karboksylową i wodorową, podlegają wspólnym reakcjom: transaminacji, dezaminacji i dekarboksylacji [10].
Reakcja transaminacji, odbywająca się nie tylkow wątrobie i w mięśniach, ale także i w innych tkankach, katalizowana przez aminotransferazy obejmuje wzajemne przemiany pary alfa-aminokwasów i pary alfa-ketokwasów, bez uwolnienia cząsteczki amoniaku jako pośredniego produktu reakcji [7,23].
Reakcja transaminacji jest reakcją odwracalną, co sprawia, że aminotransferazy uczestniczą zarówno w procesie katabolizmu, jak i biosyntezy aminokwasów. Jakkolwiek zdecydowana większość aminokwasów endogennych i egzogennych (z wyjątkiem treoniny, lizyny i proliny z hydroksyproliną) może powstać z odpowiadających im ketokwasów oraz dawcy grupy aminowej w obecności swoistej aminotransferazy, to jednak centralną rolę w procesie transaminacji odgrywają: kwas alfa-ketoglutarowy, kwas szczawiooctowy i pirogronowy, z powstającymi: glutaminianem, asparaginianem i alaniną [7,22].
Alanina jest także substratem dla transaminazy glutaminianowej, cały azot aminowy aminokwasów może więc być gromadzony w glutaminianie, co jest o tyle ważne, że L-glutaminian jest jedynym aminokwasem w komórkach ulegającym dezaminacji ze znaczną szybkością. Stąd też i tworzenie amoniaku z grup alfa-aminowych aminokwasów odbywa się głównie poprzez kwas glutaminowy [7,8], przy udziale enzymu dehydrogenazy glutaminianowej, rozpowszechnionej w wielu tkankach. W wątrobie enzym ten katalizuje w odwracalnej reakcji oddzielenie amoniaku od kwasu glutaminowego, z następowym wbudowaniem go w mocznik, w innych tkankach równowaga reakcji przesunięta jest w kierunku przyłączenia amoniaku do alfa-ketoglutaranu z utworzeniem glutaminianu [8].
Dezaminacja tlenowa polega na konwersji aminokwasu do ketokwasu i amoniaku. Reakcja ta jest katalizowana przez oksydazy L- i D-aminokwasów. Chociaż decydującą rolę w usuwaniu amoniaku z aminokwasów odgrywają reakcje katalizowane przez aminotransferazy i dehydrogenazę L-glutaminianową, to w wątrobie i w nerkach zachodzi również tlenowa przemiana aminokwasów w odpowiadające im ketokwasy [7,10,58].
Wolne aminokwasy surowicy krwi są w stanie równowagi dynamicznej [10], która jest konsekwencją ich podaży dietetycznej, absorpcji jelitowej, uwalniania z endogennych zasobów białkowych, wychwytu przez wątrobę i inne tkanki, endogennej syntezy i katabolizmu. Stężenie wolnych aminokwasów w osoczu w stanie pełnego zdrowia wykazuje względnie małe między- i wewnątrzosobnicze zmienności [9]. Utrzymanie stanu stacjonarnego stężeń aminokwasów w osoczu jest zależne od równowagi między uwalnianiem aminokwasów z endogennych zasobów białek a wykorzystaniem ich przez różnorodne tkanki ustroju. Całość tych reakcji podlega ścisłej regulacji hormonalnej [61,62].
Piśmiennictwo
1. Jakubke H.D., Jeschkeit H.; Aminokwasy. W: Jakubke H.D., Jeschkeit H.: Aminowkasy peptydy białka; PWN Warszawa 1982, 11-69
2. Munro H.N.; An introduction to nutritional aspects of protein metabolism. W: Munro H.N., Allison J.B.: Mammalian protein metabolism; Academic Press, New York 1964, 3-39
3. Rose W.C.; The amino acis requirements of adult man; Nutr. Abstr. Rev. 1957:27, 631-647
4. Rose W.C.; The nutritive significance of amina acids; Physiol. Rev. 1939:18, 109-136
5. Jackson A.A., Shaw J.C.L., Barber A., Golden M.H.N.; Nitrogen metabolism in preterm infants fed human donor breast milk the possible essentiality of glycine; Pediatri. Res 1981:15, 1454-1461
6. Neale R.J., Waterlow J.C.; Cirtical evaluation of a method for estimating amino acid requirements for maintenance in the rat by measurement of the rate of 14C – labelled amino acid oxidation in vivo; Br. J. Nutr. 1974:32, 257-272
7. Rodwell V.W.; Metabolizm białek i aminokwasów. W: Murray R.K., Granner D.K., Maeys P.A., Rodwell V.W.: Biochemia Harpera; PZWL Warszawa 1994, 337-414
8. Scriver Ch., Rosenberg L.E.; Amino acid metabolism and its disorders; W.B. Saunders Company Philadelphia, London, Toronto 1973
9. Young V.R.; Dynamics of human whole body amino acid metabolism: use of stable isotope probes and relevance to nutritional requirements; J. Nutr. Sci. Vitaminol 1981:27, 395-413
10. Bożkowa K., Duczyńska N.; Zaburzenia przemiany aminokwasów. W: Bożkowa K.: Genetycznie uwarunkowane zaburzenia metaboliczne u dzieci; PZWL Warszawa 1977, 31-64
11. Synderman S.E.; Human amino acid nutrition; Genet. Fact. Nutr. 1983 (cyt. wg 17)
12. Fürst P.; Intracellular muscle free amino acids-their measurement and function; Proc. Nutr. Soc. 1983:42, 451-464
13. Szostak D.; Metabolizm aminokwasów w encefalopatii wątrobowej; Wiad. Lek. 1988:XLI (5), 327-335
14. Van Slyke D.D., Meyer G.M.; The fate of protein digestion products in the body III. The absorption of amino-acids from the blood by tissues; J. Biol. Chem. 1913:16, 197-212
15. Jackson A.A.; Aminoacids: essential and non-essential?; Lancet 1983:1, 1034-1037
16. Herbert J.D.; Free amino acids in the caiman rat; Comp. Biochem. Phys. 1966:17(2), 58
17. Bergström J., Fürst P., Noree L.O., Vinnars E.; Intracellular free amino acid concentration in human muscle tissue; J. Appl. Physiol. 1974:36 (6), 693-697
18. Munro H.N.; Nutrition and muscle protein metabolism; Federation Proc. 1978:37 (9), 2281-2282
19. Scriver Ch., Gregory M.D., Sovetts D., Tissenbaum G.; Normal plasma free amino acid values in adults: the influence of some common physiological variables; Metabolism 1985:34, 868
20. Tadeusiak W.; Czynniki wpływające na homeostazę wolnych aminokwasów w ustroju człowieka; Pol. Tyg. Lek. 1977:XXXII, 28, 1091-1094
21. Armstrong M.D., Stave U.; A study of plasma free amino acid levels. I. Study of factors affecting validity of amino acid analyses; Metabolism 1973:22 (4), 549-560
22. Naskalski J.W.; Przemiana białek i jej udział w utrzymaniu homeostazy. W: Sznajd J.: Biochemia kliniczna w praktyce lekarskiej; PZWL Warszawa 1983, 108-128
23. Ganong W.F.; Równowaga energetyczna, metabolizm i odżywianie. W: Ganong W.F.: Fizjologia. Podstawy fizjologii lekarskiej; PZWL Warszawa 1994, 343-386
24. Hagenfeldt L., Eriksson L.S., Wahren J.; Amino acids in liver disease; Proc. Nutr. Soc. 1983:42, 497-452
25. Christensen H.N.; Biological Ttransport, Reading, Mass; W.A. Benjamin,; Inc. 1975, (cyt. wg 109)
26. Felig P.; Amino acid metabolism in man; Annu Rev. Biochem. 1975:44, 933-958
27. Felig P., Pozefsky T., Marliss E., Cahill G.F. Jr.; Alanine: key role in glukoneogenesis; Science 1970:167, 1003-1004
28. London D.R., Foley T.H., Webb C.G.; Evidence for the release of individual amino acids from the resting human forearm; Nature 1965:108, 588-592
29. Pozefsky T., Felig P., Tobin J., Soeldner J.S., Cahill G.F. Jr.; Amino acid balance across the tissue of the forearm in postabsorptive man:effects of insulin at two dose levels; J. Clin. Invest. 1969:48, 2273-2282
30. Carlsten A., Hallgren B., Jagenburg R., Svanborg A., Werko L.; Myocardial metabolism of glucose, lactic acid, amino acids and fatty acids in healthy human individuals at rest and at different work loads; Scand. J. Clin. Lab. Invest. 1961:13, 418-454
31. Felig P., Wahren J.; Amino acid metabolisam in exercising man; J. Clin. Invest. 1971:50, 2703-2709
32. Marliss E.B., Aoki T.T., Pozefsky T., Most A.S., Cahill G.F. Jr.; Muscle and splanchnic glutamine and glutamate metabolism in postabsorptive and starved man; J. Clin. Invest. 1971:50, 814-817
33. Felig P.; The glucose – alanine cycle. Metabolism, 1973:22, 179-207 [Odessey R., Khairallah E.A., Goldberg A.L.: Origin and possible significance of alanine production by skeletal muscle; J. Biol. Chem. 1974:249, 7623
34. Garber A.J., Karl I.E., Kipnis D.M.; Alanine and glutamine synthesis and release from skeletal muscle; J. Biol. Chem. 1976:251, 836-839
35. Goldstein A.L., Newsholme E.A.; The formation of alanine from aminoacids in diaphragm muscle of the rat; Biochem. J. 1976:154, 555-559
36. Manchester K.L.; Oxidation of amino acids by isolated rat diaphragm and the influence of insulin; Biochim. Biophys. Acta 1965:100, 295-299
37. Wilk M., Wojtczak A.B.; Metabolizm aminokwasów o rozgałęzionym łańcuchu węglowym; Post. Biochem. 1979:25, 141-153
38. Felig P., Owen O.E., Wahren J., Cahill G.F. Jr.; Amino acid metabolism during prolonged starvation; J. Clin. Invest. 1969:48, 584-593
39. Felig P., Marliss E., Ohman J.L., Cahil G.E.; Plasma amino acid levels in diabetic ketoacidesis; Diabetes 1970:19, 727-732
40. Harper A.E.; Some recent developments in the study of amino acid metabolism; Proc. Nutr. Soc. 1983:42, 437-449
41. Smith R., Elia M.; Branched-chain amino acids in catabolic states; Proc. Nutr. Soc. 1983:42, 473-487
42. Felig P., Wahren J., Hendler R., Brundin T.; ; J. Clin. Invest. 1974:53, 582-590 (cyt. wg 26)
43. Goldberg A.L., Chang T.W.; Regulation and significance of amino acid metabolism in skeletal muscle; Fed Proc. 1978:37, 2301-2307
44. Allison J.B., Wannemacher R.W. Jr., Banks W.L. Jr.; Influence of dietary protein on protein biosynthesis in various tissues; Federation Proc. 1963:22, 1126-1130
45. Christensen H.N.; Conjugated amino-acids in portal plasma of dogs after protein feeding; Biochem. J. 1949:44, 333-339
46. Clemetson C.A.B., Churchman J.; Plasma amino-acid levels following protein ingestion by pregnant and non-pregnant subjects; J. Obstet. Gynaec. Brit. Emp. 1955:62, 390-396
47. Dent C.E., Schilling J.A.; Studies on the absorption of proteins: The amino-acid pattern in the portal blood; Biochem. J. 1949:44, 318-321
48. Denton A.E., Elvehjem C.A.; Availability of amino acids in vivo; J. Biol. Chem. 1954:206, 449-452
49. Holmgren G.; Effect of low, normal and high dietary protein intake on urinary aminoacid excretion and plasma aminogram in children; Nutr. Metabol. 1974:16, 223-228
50. Mellinkoff S.M., Jenden D.J., Frankland M.; Postprandial serum amino acid levels in viral hepatitis; A. M. A. Arch Intern. Med. 1954:94, 604
51. Steele B.F., Reynold M.S., Baumann C.A.; Effect of diet on amino acids in blood and urine of mice of various ages; Arch. Biochem. 1950:25, 124-126
52. Van Slyke D.D., Meyer G.M.; The aminoacid nitrogen of blood. Preliminary experiments on protein assimilation; J. Biol. Chem. 1912:12, 399
53. Van Slyke D.D., Meyer G.M.; The fate of protein digestion products in the body III. The absorption of amino-acids from the blood by tissues; J. Biol. Chem. 1913:16, 197-212
54. West C.D., Wilson J.L., Eyles R.; Blood amino nitrogen levels. Changes in blood amino nitrogen levels folloving ingestion of proteins and of a protein hydrolysate in infants with normal and with deficient pancreatic function; Amer J. Dis. Child. 1946:72, 251-258
55. Wheeler P., Morgan A.F.; The absorption by immature and adult rats of amino acids from raw and autoclaved fresh pork; J. Nutr. 1958:64, 137-139
56. Goldberg A.L., Odessey R.; Oxidation of amino acids by diaphragms from fed and fasted rats; Am. J. Physiol. 1972:233, 1384-1389
57. Best C.H., Taylor N.B.; Metabolizm i odżywianie. W: Best C.H., Taylor N.B.: Fizjologiczne podstawy postępowania lekarskiego; PZWL Warszawa 1971, 1552-1589
58. Frame E.G.; The levels of individual free amino acids in the plasma of normal man at various intervals after a high protein meal; J. Clin. Invest. 1958:37, 1710-1723
59. Wahren J., Felig P., Hagenfeldt J.; Effects of protein ingestion on splanchnic and leg metabolism in normal man and in patients with diabetes mellitus; J. Clin. Invest. 1976:57, 987-992
60. Coulson R., Hernandez T.; Amino acid catabolism in the intact rat; Am. J. Physiol. 1968:215 (3), 741-746








