Endokrynol. Ped. 12/2013;4(45):9-18
DOI: 10.18544/EP-01.12.04.1463
Synapsy immunologiczne pomiędzy limfocytami a komórkami nabłonkowymi tarczycy w autoimmunizacyjnych chorobach tarczycy.
1Klinika Endokrynologii i Diabetologii Dzieciecej Uniwersytetu Medycznego w Lublinie
2Oddział Chirurgii Ogólnej Wojewódzkiego Szpitala Specjalistycznego w Lublinie
Słowa kluczowe: synapsy immunologiczne, autoimmunizacyjne choroby tarczycy
Streszczenie
Wstęp. Synapsy immunologiczne opisywano jako wyspecjalizowane połączenia międzykomórkowe pomiędzy limfocytami T a komórkami prezentującymi antygen. Synapsa immunologiczna składa się z centralnej przestrzeni zawierającej receptory antygenowe i otaczającego ją pierścienia cząsteczek adhezyjnych. Cel badań. Obserwacja synaps immunologicznych in vivo w autoimmunizacyjnych chorobach tarczycy. Metody. W elektronowym mikroskopie transmisyjnym zbadano seryjne skrawki tarczyc 30 pacjentów z chorobą Gravesa i Basedowa: 30 pacjentów z zapaleniem tarczycy typu Hashimoto i 30 dzieci bez zaburzeń czynności tarczycy. Wyniki. W chorobie Gravesa-Basedowa niespolaryzowane limfocyty T formowały synapsy immunologiczne z aktywnymi tyreocytami. Limfocyty tworzyły wypustki – lamellipodia i łączyły się z błoną komórkową tyreocytów, podobne struktury wytwarzane były pomiędzy plazmocytami a tyreocytami. Ultrastrukturalnie są to strefy przylegania ograniczające przestrzeń, do której wydzielane są przeciwciała. To w tych miejscach, jak można przypuszczać, dochodzi do prezentacji antygenów przez tyreocyty. W zapaleniu tarczycy typu Hashimoto limfocyty T i plazmocyty łączące się z tyreocytami były spolaryzowane – centriole, aparat Golgiego, pęcherzyki wydzielnicze i mitochondria umocowane przez mikrotubule znajdowały się w części komórki limfatycznej przylegającej do uszkadzanego tyreocytu. W ten sposób tworzyły one cytotoksyczne synapsy w zapaleniu typu Hashimoto. Również miejsca kontaktów limfocytów T i B spełniały kryteria definicji synapsy immunologicznej. W grupie kontrolnej nie obserwowano tego rodzaju połączeń komórkowych. Wnioski. W chorobach autoimmunizacyjnych tarczycy tworzą się synapsy immunologiczne pomiędzy limfocytami i plazmocytami a nabłonkowymi komórkami tarczycy. Ich struktura: obwodowa strefa zamykania lub przylegania i centralna ograniczona przestrzeń są charakterystyczne dla wszystkich rodzajów synaps immunologicznych. Polaryzacja limfocytów jest charakterystyczna dla synaps cytotoksycznych
Wstęp
Synapsy immunologiczne to wyspecjalizowane połączenia międzykomórkowe pomiędzy limfocytami T a komórkami prezentującymi antygen [1–4] jak również połączenia pomiędzy różnymi limfocytami, komórkami Natural killer i innymi [5]. Te połączenia międzykomórkowe stanowią ogniska lokalne egzo- i endocytozy [6]. Liczne badania wyjaśniają budowę synapsy immunologicznej. Synapsa jest zbudowana z obszaru centralnego: tzw. central supramolecular activation complex SMAC [cSMAC], zawierającego receptory lifocytów T (TCR) i powiązane z nimi liczne białka sygnałowe oraz z regionu obwodowego: tzw. peripheral SMAC (pSMAC) – jest to pierścień białek adhezyjnych otaczający reaktywne centrum [7]. Wydzielona przestrzeń SMAC jest miejscem egzocytozy i endocytozy, ale precyzyjne miejsce przekazywania sygnału między komórkami nie zostało dotychczas poznane [8]. Aby sygnał przekazywany do wnętrza komórki przez synapsę immunologiczną nie okazał się zbyt słaby, dochodzi do powstania mikroskupisk aktywujących.
Wyróżnia się następujące elementy dojrzałej synapsy:
centrum synapsy, cSMAC (ang. SupraMolecular Activaction Clusters) – tworzą ją zgrupowane receptory TCR wraz z CD3, CD4 lub CD8,
cząsteczki kostymulujące na limfocytach T będące receptorami CD28, ICOS1, CD2,
cząsteczki kostymulujące na komórkach APC będące ligandami CD28/CD80,
cytoplazmatyczne białka przekaźnikowe, np. kinazy PKC-θ oraz IKK
część peryferyjną synapsy, pSMAC – tworzy ją pierścień cząsteczek adhezyjnych (LFA1, VLA-4, białka ADAP, tialina oraz receptor dla transferyny) część dystalną synapsy, dSMAC – tworzą ją cząsteczki CD43 oraz fosfatazy [9–12]. Limfocyty CD4 tworzą długodziałające synapsy z komórkami prezentującymi antygen APCs – ich czas aktywności to kilka godzin. Limfocyty CD8 formują przejściowe synapsy, działające kilka minut, ponieważ ich komórki docelowe w tym czasie ulegają zniszczeniu [13, 14]. W takiej cytotoksycznej synapsie kinazy Src są wykrywalne w cSMAC [13]. Centralny obszar synapsy cSMACs odgrywa istotną rolę nie tylko w przekazywaniu sygnału immunologicznego, ale również w odtwarzaniu receptorów poprzez polaryzację kompartmentów komórki przylegających do cSMAC [15]. W czasie formowania synapsy występuje zależna od antygenu polaryzacja mikrotubul cytoskeletonu i organelli komórkowych. Aktywacja receptorów limfocytów prowadzi do akumulacji aktyny wokół synapsy i utworzenia zewnętrzego pierścienia utrzymującego strefę przylegania [16, 17]. Reakcja cytotoksyczna limfocytów CD8 jest związana z uwalnianiem lizosomów zawierających białko perforynę oraz granzymy, które prowadza do szybkiej apoptozy komórki docelowej [17]. W miejscu tworzenia się synapsy w limfocycie obecne są centrosomy kształtujące poprzez system mikrotubul powierzchnię błony komórkowej i przestrzeń wewnątrz cytoplazmy [18]. Granule lityczne powstają w wyspecjalizowanych domenach cytoplazmy i są przesuwane wzdłuż mikrotubul na powierzchnię błony komórkowej, gdzie w przestrzeni synaptycznej uwalniana jest ich zawartość uszkadzająca komórkę docelową [17]. Griffiths sugeruje że centrosomy odgrywają rolę w identyfikowaniu obszarów błony komórkowej wyspecjalizowanych w egzo- i endocytozie [6]. Ważną rolę w formowaniu synapsy immunologicznej ma lokalizacja mitochondriów – mitochondria aktywują i dezaktywują czynność synapsy immunologicznej [19]. Uwidocznienie aktywacji limfocytów T in vivo jest bardzo skomplikowane. W modelu eksperymentalnym z użyciem podskórnej iniekcji znakowanych aktywowanych komórek dendrytycznych oraz następowej iniekcji naiwnych trangenicznych limfocytów CD8+ obserwowano trzy fazy aktywacji limfocytów T [20]:
Faza 1 – wstępna aktywacja limfocytu przez komórkę prezentującą antygen, powodująca gwałtowną migrację limfocytu T, trwa 30 minut do 8 godzin i zależy od p MHC.
Faza 2 – okres stabilnej interakcji limfocytu T I komórki docelowej, trwa ok 2 godzin – produkowana jest wówczas interleukina 2 (IL2). Sygnał jest integrowany przez synapsę immunologiczną.
Faza 3 – powrót do luźnego kontaktu pomiędzy limfocytem a komórką docelową, szybka migracja limfocytu T, możliwośc podziałów limfocytu T (tak powstaja komórki pamięci immunologicznej) [21, 22].
Cel badania
Prezentacja ultrastruktury synaps immunologicznych pomiędzy limfocytami T i B a komórkami docelowymi tarczycy w autoimmunizacyjnych chorobach tarczycy.
Materiał i metod
Pacjenci
Grupa dzieci i młodzieży została wybrana do badań w celu wykluczenia zmian związanych z wiekiem, chorób układu krążenia, miażdżycy, działania różnych leków.
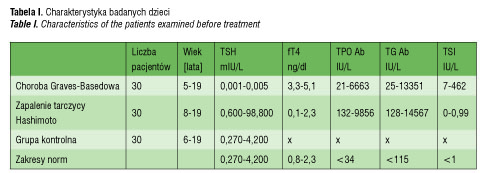
Badanie obejmowało 90 dzieci: 30 dzieci z chorobą Graves-Basedowa, 30 dzieci z zapaleniem tarczycy Hashimoto i 30 dzieci zdrowych stanowiących grupę kontrolną. Dzieci były leczone w Klinice Endokrynologii i Neurologii Dziecięcej UM w Lublinie i w Oddziałe Dziecięcym Wojewódzkiego Szpitala Specjalistycznego w Rzeszowie. Operowano je z powodu chorób tarczycy w latach 1994–2007 w Oddziałach Chirurgicznych Wojewódzkiego Szpitala Specjalistycznego w Lublinie i w Rzeszowie.
Grupa kontrolna
Grupę kontrolną stanowiły dzieci zmarłe z powodu wypadków, innych chorób nieautoimmunologicznch, u których fragmenty tarczycy pobierano
w czasie autopsji [25]. Część preparatów tarczycy [5] pozyskano w trakcie operacji z powodu torbieli szyi lub przytarczyc – stanowiły one fragmenty wycinków tkankowych pobieranych do standardowych badań histopatologicznych. Wszystkie dzieci były w eutyreozie (tab. I).
Rodzice dzieci podpisali świadomą zgodę na badania przed autopsją lub operacją.
Badanie zostało zaakceptowane przez Komisję Bioetyczną Uniwersytetu Medycznego w Lublinie.
Procedura kwalifikacji pacjentów
Wszystkie dzieci kwalifikowane do grup badanych były badane fizykalnie w celu określenia wielkości wola i oceny klinicznych objawów czynności tarczycy. Oznaczano u nich poziom TSH ultraczułą metodą immunoenzymatyczną (MEIA), wolnej tyroksyny i trójjodotyroniny we krwi obwodowej metodą immunoenzymatyczną (EIA) przy użyciu aparatu i odczynników firmy ABBOTT. Określano poziom przeciwciał przeciwtarczycowych przeciw peroksydazie tarczycowej (TPO Ab), tyroglobulinie (TGAb) metodą LIA (Lumitest BRAHMS Diagnostica GMbH, Berlin, Germany). U dzieci z nadczynnością tarczycy dodatkowo oznaczano poziom przeciwciał przeciw receptorowi dla TSH met. RIA lub LIA (BRAHMS Diagnostica GMbH, Berlin, Germany). Oznaczenia poziomów przeciwciał przeciwtarczycowych były podstawą do rozpoznania autoimmunizacyjnej choroby tarczycy (AITD).
U każdego dziecka wykonywano badanie ultrasonograficzne gruczołu tarczowego. Za kryteria wykluczenia uznano inne choroby autoimmunizacyjne występujące u pacjenta i choroby nowotworowe układu immunologicznego.
Choroba Gravesa-Basedowa
Pacjenci, u których rozpoznano chorobę Gravesa-Basedowa zgłaszali się z powodu wola, objawów nadczynności tarczycy: niepokoju, bezsenności, tachykardii, dużej amplitudy ciśnień, rzadko wytrzeszczu gałek ocznych (20% badanych). Nadczynność tarczycy potwierdzały badania laboratoryjne: obniżone TSH przy podwyższonej wolnej tyroksynie i/lub trójjodotyroninie. Poziomy przeciwciał przeciw receptorowi dla TSH były podwyższone. Przeciwciała przeciw peroksydazie tarczycowej (TPO Ab) i przeciw tyroglobulinie (TG Ab) również przekraczały górne granice normy.
W badaniu ultrasonograficznym stwierdzano niejednorodną echogeniczność tarczycy oraz wzmożone przepływy krwi w opcji Power Doppler. Dzieci leczone były metimazolem w dawce początkowej 0,5–0,9mg/kg m.c./ dobę przez 4–6 tygodni, redukowanej potem, gdy uzyskały stan eutyreozy, do dawki podtrzymującej 5 mg/dobę (0,1–0,2 mg/kg m.c./dobę). W okresie leczenia podtrzymującego często potrzebna była dodatkowa suplementacja l-tyroksyny w dawce 12,5–25 mg/dobę. Do zabiegu tyroiektomii kwalifikowani byli pacjenci po drugim nawrocie nadczynności tarczycy (po 48 miesiącach leczenia farmakologicznego) lub pacjenci, u których nie udało się uzyskać remisji choroby po 24 miesiącach leczenia. Przed samym zabiegiem dawki leków zwiększano, aby wprowadzić dziecko w stan eutyreozy i podawano jod, aby zablokować czynność tarczycy w czasie operacji i uchronić pacjenta przed rozwojem przełomu tarczowego. Oceniano więc reakcje immunologiczne po długim czasie trwania choroby i stosowania leków, które wpływają zarówno na metabolizm komórek tarczycy jak
i na przebieg reakcji immunologicznej (tab. I).
Zapalenie tarczycy typu Hashimoto
Autoimmunizacyjne zapalenie tarczycy rozpoznawano u pacjentów z wolem miąższowym lub guzkowym w fazie prawidłowej czynności, niedoczynności lub rzadziej nadczynności tarczycy (Hashitoxicosis). W badaniu ultrasonograficznym obserwowana była niejednorodna echogeniczność tarczycy. Poziom przeciwciał TPO Ab i/lub TG Ab był podwyższony, a u osób z nadczynnością tarczycy poziom TRAb pozostawał w zakresie wartości referencyjnych (nadczynność tarczycy w ciągu 1–2 miesięcy przechodziła w stan eutyreozy potem hipotyreozy). W badaniu histopatologicznym stwierdzano nacieki limfocytowe z obecnością grudek chłonnych w preparatach tarczycy. Pacjenci przed zabiegiem przez 6–36 miesięcy leczeni byli l-tyroksyną w dawce 25–100µg na dobę (tab. I).
Badania ultrastrukturalne
Skrawki tarczycy do badań ultrastrukturalnych były pobierane w trakcie zabiegu operacyjnego tyreoidektomii lub odzyskiwane z preparatów parafinowych.
Małe fragmenty tarczycy uzyskane w trakcie zabiegu operacyjnego były krojone na skrawki o objętości ok. 0,5 mm³ i utrwalane w 4% glutaraldehydzie w 0,1 M buforze kakodylowym o pH 7,4 przez 24 godziny w temp. 4º C. Następnie były utrwalane w 2% OsO4 w tym samym buforze przez jedną godzinę w temperaturze pokojowej, odwadniane w szeregu alkoholi i zatapiane w Eponie 812.
Skrawki tarczycy pobierane z bloczków parafinowych były pozbawiane parafiny poprzez kąpiele w ksylenie i uwadniane w szeregu alkoholi o malejącym stężeniu i w wodzie destylowanej. Utrwalanie przeprowadzano w 2,5% glutaraldehydzie w buforze fosforanowym przez 4 godziny w temp. 4º C. Następnie płukano w 7,5% roztworze sacharozy buforze fosforanowym 12–24 godzin w temp. 4º C i utrwalano 2% OsO4 w buforze Michaelisa przez 2 godziny, a potem płukano w tym buforze, odwadniano i zatapiano Eponie 812.
Na tak przygotowanych preparatach przeprowadzano polimeryzację w temperaturze 60ºC. Bloczki eponowe były krojone na ultramikrotomie RMC –MT-7 (RMC Tucson Arizona USA) i Power Tome PC (RMC Products). Oceniano początkowo preparaty półcienkie barwione błękitem metylenu, a następnie preparaty ultracienkie kontrastowane 8% octanem uranylu oraz cytrynianem ołowiu i płynem Reynoldsa. Preparaty oceniano i fotografowano w transmisyjnym mikroskopie elektronowym EM 900 Zess Germany Elektron Microscope i w mikroskopie transmisyjnym JEM-1011 (JEOL).
Wyniki
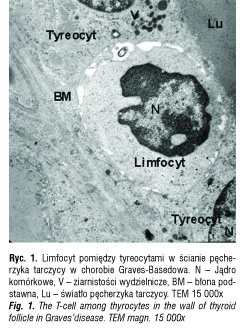
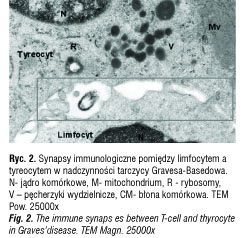
W grupie kontrolnej dzieci bez chorób tarczycy limfocyty były obserwowane sporadycznie w śródmiąższu gruczołu tarczowego. Komórki limfatyczne nie przechodziły przez błonę podstawną pęcherzyków tarczycowych, nie kontaktowały się z tyreocytami i nie formowały grup. W chorobie Graves-Basedowa limfocyty T przenikały przez błony podstawne pęcherzyków drogą diapedezy i wchodziły w ścisły kontakt z tyreocytami (ryc. 1) Limfocyty migrowały do pęcherzyków tarczycowych z naczyń włosowatych lub z grudek chłonnych. Migrujące limfocyty T miały liczne wypustki – lamellipodia na powierzchni. Polaryzacja organelli komórkowych była widoczna już w limfocytach wędrujących przez wąskie naczynia włosowate. Lamellipodia, mitochondria i aparat Golgiego były zlokalizowane w tej samej części limfocytu. Podobnie wyglądały limfocyty T penetrujące błonę podstawną pęcherzyków tarczycy. Limfocyty T tworzyły liczne połączenia z tyreocytami. Struktura tych połączeń była podobna do zonula occludens: obwodowo pierścień przylegających do siebie błon komórkowych i centralnie wolna przestrzeń, do której uwalniane były substancje białkowe. Limfocyty T tworzące te połączenia nie były spolaryzowane. Tyrocyty nie były uszkodzone, ale aktywne, miały liczne mitochondria, pęcherzyki sekrecyjne i dużą ilość euchromatyny w jądrze komórkowym (ryc. 2).
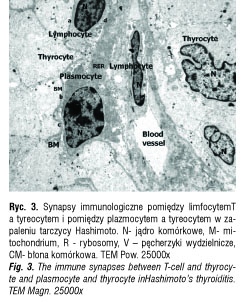
W zapaleniu tarczycy typu Hashimoto miejsca kontaktu pomiędzy limfocytami T a tyreocytami miały również charakter synapsy immunologicznej. Te synapsy wyglądały inaczej. Limfocyty T były spolaryzowane: centriole, mitochondria, aparat Golgiego i pęcherzyki sekrecyjne były obecne w części połączonej z tyreocytem. Synapsa była zbudowana z części obwodowej – strefy przylegania błon komórkowych i z części centralnej – przestrzeni, do której były wydzielane gęste elektronowo substancje. Tyreocyty pozostające w kontakcie
z limfocytami T prezentowały cechy apoptozy: ciemną skoncentrowaną chromatynę w jądrze komórkowym, obrzęk mitochondriów, poszerzone cysterny siateczki śródplazmatycznej (ryc. 3).
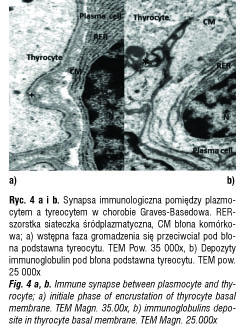
W AITD obserwowane były również synapsy pomiędzy limfocytami B (plazmocytami) a tyreocytami. W chorobie Graves-Basedowa dystalna, obwodowa cześć synapsy – zone adherens była utworzona bez fuzji błon komórkowych plazmocytu i tyreocytu, a w części centralnej była obecna przestrzeń z błonami komórkowymi. Do tej przestrzeni wydzielane były gęste elektronowo substancje z szorstkiej siateczki endoplazmatycznej plazmocytu – immunoglobuliny. Inkrustowały one błonę podstawną tyreocytów. Komórki nabłonka pęcherzykowego tarczycy pozostające w kontakcie z komórkami plazmatycznymi były aktywne: z dużą ilościa euchromatyny w jądrze, licznymi pęcherzykami sekrecyjnymi i rozbudowanymi mikrokosmkami (ryc. 4a i b).
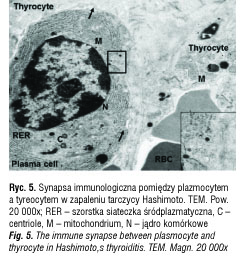
W zapaleniu tarczycy Hashimoto obserwowano również polaryzację plazmocytów: centriole, aparat Golgiego, mitochondria i dobrze rozwinięta siateczka śródplazmatyczna widoczna zazwyczaj w części połączonej z tyreocytem. W niektórych miejscach obserwowano sekrecję substancji o średniej gęstości elektronowej z komórki plazmatycznej do tyreocytu. Plazmocyty przylegały na dużej powierzchni do błony komórkowej tyreocytów, a te wykazywały cechy uszkodzenia: fragmentację reticulum endoplazmatycznego, obrzęknięte mitochondria, kondensację chromatyny w jądrze. W zaawansowanym stadium obserwowano destrukcję i fragmentację tyreocytów (ryc. 5).
Dyskusja
Molekularna struktura synaps immunologicznych badana jest najczęściej w hodowlach komórkowych, niewiele jednak wiadomo na temat biofizycznych i ultrastrukturalnych interakcji w pomiędzy limfocytami a komórkami docelowymi w tkankach [21].
Synapsy immunologiczne występujące w tarczycy pacjentów z chorobą Graves-Basedowa są podobne do synaps opisanych przez Dustina [23]. Badania dynamiczne w hodowlach komórkowych wykazały, że synapsy immunologiczne tworzone są w wyniku aktywacji receptorów TCR: najpierw formowana jest część obwodowa, adhezyjna pSMAC, a potem centralna cSMAC w procesie zależnym od konformacji włókien F-aktyny, trwającym kilka minut [7]. Połączenia pomiędzy limfocytami T a tyreocytami: zone occludens w chorobie Graves-Basedowa i zone adherens w zapaleniu tarczycy Hashimoto odpowiadają pSMAC, a przestrzeń w centrum cSMAC.
Interesująca jest różnica w polaryzacji limfocytów w synapsach immunologicznych. Limfocyty stymulujące tyreocyty w chorobie Graves-Basedowa nie były spolaryzowane, ale cytotoksyczne limfocyty w zapaleniu tarczycy typu Hashimoto wykazywały wyraźną polaryzację organelli komórkowych. Polaryzacja limfocytów T: formowanie centrioli, układ mitochondriów i kompleksu Golgiego sugeruje specjalną organizację tubul i mikrofilamentów. Filamenty aktyny (F-actin) odgrywają krytyczną rolę w różnych stadiach aktywacji limfocytów T. Polimeryzacja aktyny prowadzi do skurczu i zmiany konfiguracji cytoskeletonu z tworzeniem lamellipodium, co umożliwia szybkie przemieszczanie sie limfocytów w naczyniach włosowatych i tkankach [24]. Centrum organizujące mikrotubule (microtubule organizing center, MTOC) i komórkowa sieć mikrotubul stanowią molekularną drogę, która umożliwia poruszanie sie pęcherzyków wydzielniczych i jest oparciem dla polaryzacji funkcji komórki. Po stymulacji TCR to właśnie MTOC powoduje polaryzację organelli limfocytu i tworzenie synapsy immunologicznej. Polaryzacja jest ważna, aby przemieszczanie i sekrecja pęcherzyków zawierających enzymy cytolityczne przebiegała w kierunku komórki docelowej – tyreocytu, a sam akt sekrecji odbywał się do szczeliny synaptycznej. Zabezpiecza to limfocyt przed zniszczeniem [25–27].
Wcześniejsze badania [28–30] opisywały, że mitochondria gromadzą się w pobliżu synapsy immunologicznej w wyniku stymulacji limfocytu T. Czynnik DRP1 (dynamin-related protein 1) reguluje rozmieszczenie mitochondriów ściśle w okolicy pSMAC i cSMAC [19]. Synapsa immunologiczna jest kontrolowana przez sygnały wapniowe i zależne od wapnia funkcje limfocytu T [31]. Nasze obserwacje in vivo są analogiczne do badań ultrastrukturalnych w hodowli komórkowej prowadzonych przez Tsuni wsp. [32]. Prawdopodobnie polaryzacja organelli w limfocytach cytotoksycznych jest związana z transportem cytotoksycznych substancji z limfocytów do tyreocytów.
Stinchcombe [33] obserwował komórki NK połączone z limfocytami B i glikolipidy zawierające antygeny CD1. Badania ultrastrukturalne synapsy immunologicznej pomiędzy komórkami NK i INK a komórkami docelowymi (target cells) ujawniły, że w komórkach cytolitycznych centriole mogą być związane (umocowane) w blonie komórkowej w pobliżu synapsy immunologicznej. Pęcherzyki sekrecyjne są uwidocznione w szczelinie synaptycznej, a lizosomy sekrecyjne spolaryzowane wzdłuż mikrotubul umocowanych w centrosomie. Aparat Golgiego i odnawialne endosomy są również umocowane w biegunie komórki sąsiadującej z synapsą [33]. Wydaje się, że proces polaryzacji jest ściśle związany z cytotoksycznym oddziaływaniem limfocytów T na komórki pęcherzykowe tarczycy w zapaleniu tarczycy Hashimoto.
Rzadko opisywane są synapsy immunologiczne pomiędzy komórkami plazmatycznymi a APCs. Pierwszy opisał je Batista [34]. My opisalismy dwa typy synaps immunologicznych pomiędzy plazmocytami a tyreocytami w AITD. W chorobie Graves-Basedowa istnieją synapsy stymulujace: immunoglobuliny inkrustujące błonę podstawną tyreocytów są wydzielane do cSMAC i wiążą się z receptorem TSH, pobudzając czynność tyreocytów. W końcowej fazie tego procesu widoczne są gęste elektronowo depozyty immunoglobulin. Podobne zmiany były obserwowane przez innych badaczy w zapaleniu kłębków nerkowych [35, 36]. W glomerulonephritis obserwowano podśródbłonkowe depozyty dopełniacza [36, 37] i podnabłonkowe (podobnie jak w tarczycy) depozyty immunoglobulin [35, 36].
W zapaleniu tarczycy typu Hashimoto komórki plazmatyczne były spolaryzowane i formowały centrum komórkowe MTOC złożone z centrioli, mitochondriów i aparatu Golgiego oraz mikrotubul i mikrofilamentów. Zona adherens otaczała miejsce sekrecji immunoglobulin, które przenikały do tyreocytów i prowadziły do ich uszkodzenia [38].
Wnioski
1. W AITD są obecne synapsy immunologiczne pomiędzy limfocytami T i plazmocytami a komórkami nabłonkowymi tarczycy.
2. Ultrastruktura synapsy immunologicznej: obwodowa zone occludens or zone adherens i przestrzeń centralna jest obserwowana we wszystkich rodzajach synaps.
3. Limfocyty formujące synapsy cytotoksyczne charakteryzują się obecnością centrum komórkowego MTOC i polaryzacją organelli komórkowych.
Praca była finansowana z Grantu 2P05E04327 Ministerstwa Nauki Szkolnictwa Wyższego.
Piśmiennictwo
1. Poo W.J., Conrad L., Janeway Jr. C.A.; Receptor-directed focusing of lymphokine release by helper T cells; Nature 1988:332, 378–380
2. Kupfer A., Swain S.L., Singer S.J.; The specific direct interaction of helper T cells and antigen-presenting B cells. II. Reorientation of the microtubule organizing center and reorganization of the membrane-associated cytoskeleton inside the bound helper T cells ; J. Exp. Med. 1987:165, 1565–1580
3. Kupfer A., Singer S.J.; The specific interaction of helper T cells and antigen-presenting B cells. IV. Membrane and cytoskeletal reorganizations in the bound T cell as a function of antigen dose; J. Exp. Med. 1989:170, 1697–1713. doi:10.1084/jem.170.5.1697
4. Grakoui A., Bromley S.K., Sumen C. et al.; The immunological synapse: a molecular machine controlling T cell activation; Science 1999:285 (5425), 221–227
5. Davis D.M., Chiu I., Fassett M. et al.; The human natural killer cell immune synapse; Proc. Natl. Acad. Sci. USA 1999:96(26), 15062–15067
6. Griffiths G.M., Tsun A., Stinchcombe J.C.; The immunological synapse: a focal point for endocytosis and exocytosis; J. Cell. Biol. 2010:189, 3, 390–408
7. Monks C.R., Freiberg B.A., Kupfer H. et al.; Three-dimensional segregation of supramolecular activation clusters in T cells; Nature 1998:395, 82–86
8. Dustin M.L.; The cellular context of T cell signaling; Immunity 2009:30, 482–492
9. Campi G., Varma R., Dustin M.L.; Actin and agonist MHC–peptide complex–dependent T cell receptor microclusters as scaffolds for signaling; J. Exp. Med. 2005:202, 1031–1036
10. Yokosuka T., Sakata-Sogawa K., Kobayashi W. et al.; Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76; Nat. Immunol. 2005:6, 1253–1262
11. Varma R., Campi G., Yokosuka T. et al.; T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster; Immunity 2006:25, 117–127
12. Depoil D., Fleire S., Treanor B.L., Batista F.D. et al.; CD19 is essential for B cell activation by promoting B cell receptor-antigen microcluster formation in response to membrane-bound ligand; Nat. Immunol. 2008:9, 63–72
13. Beal A.M., Anikeeva N., Varma R. et al.; Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain; Immunity 2009:31, 632–642
14. Jenkins M.R., Tsun A., Stinchcombe J.C., Griffiths G.M.; The strength of T cell receptor signal controls the polarization of cytotoxic machinery to the immunological synapse; Immunity 2009:31, 621–631
15. Das V., Nal B., Dujeancourt A. et al.; Activation-induced polarized recycling targets T cell antigen receptors to the immunological synapse; involvement of SNARE complexes; Immunity 2004:20, 577–588
16. Stinchcombe J.C., Barral D.C., Mules E.H. et al.; Rab27a is required for regulated secretion in cytotoxic T lymphocytes; J. Cell. Biol. 2001:152, 825–834
17. Stinchcombe J.C., Griffiths G.M.; Secretory mechanisms in cell-mediated cytotoxicity; Annu. Rev. Cell Dev. Biol. 2007:23, 495–517
18. Stinchcombe J.C., Majorovits E., Bossi G. et al.; Centrosome polarization delivers secretory granules to the immunological synapse; Nature 2006:443, 462–465
19. Junker C., Hoth M:; Immune synapses: mitochondrial morphology matters; EMBO Journal 2011:30, 1187–1189
20. Mempel T.R., Henrickson S.E., Von Andrian U.H.; T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases; Nature 2004:427, 154–159
21. Hosseini B.H., Louban I., Djandji D. et al.; Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy; Proc. Natl. Acad. Sci. USA, 2009:106, 17852–17857
22. Scholer A., Hugues S., Boissonnas A. et al.; Intercellular adhesion molecule-1-dependent stable interactions between T cells and dendritic cells determine CD8+ T cell memory; Immunity 2008:28, 258–70
23. Dustin M.L.; The immunological synapse; Arthritis Res Therapy 2002:4 (Suppl 3), 119–125
24. Giannone G., Dubin-Thaler B.J., Rossier O. et al.; Lamellipodial actin mechanically links myosin activity with adhesion-site formation; Cell 2007:128, 561–575
25. Geiger B., Rosen D., Berke G.; Spatial relationships of microtubule-organizing centers and the contact area of cytotoxic T lymphocytes and target cells; J. Cell. Biol. 1982:95, 137–143
26. Kupfer A., Dennert G., Singer S.J.; Polarization of the Golgi apparatus and the microtubule-organizing center within cloned natural killer cells bound to their targets; Proc. Natl. Acad. Sci. USA 1983:80, 7224–7228
27. Kupfer A., Mosmann T.R., Kupfer H.; Polarized expression of cytokines in cell conjugates of helper T cells and splenic B cells ; Proc. Natl. Acad. Sci. USA 1991:88, 775–779
28. Quintana A., Schwindling C., Wenning A.S. et al.; T cell activation requires mitochondrial translocation to the immunological synapse; Proc. Natl. Acad. Sci. USA 2007:104, 14418–14423
29. Contento R.L., Campello S., Trovato A.E. et al.; Adhesion shapes T cells for prompt and sustained T-cell receptor signaling; EMBO J 2010:29, 4035–4047
30. Baixauli F., Martín-Cófreces N.B., Morlino G. et al.; The mitochondrial fission factor dynamin-related protein 1 modulates T-cell receptor signaling at the immune synapse; EMBO J 2011:30, 1238–1250
31. Kummerow C., Junker C., Kruse K. et al.; The immunological synapse controls local and global calcium signals in T lymphocytes; Immunol. Rev. 2009:231, 132–147
32. Tsun A., Qureshi I., Stinchcombe J.C. et al.; Centrosome docking at the immunological synapse is controlled by Lck signaling; J. Cell. Biol. 2011:192, 663-674, (10.1083/jcb.201008140)
33. Stinchcombe J.C., Salio M., Cerundala V. et al.; Centriole polarization to the immunological synapse direct secretion from cytolytic cells of both the innate and adaptive immune systems; BMC Biology 2011, 9–45
34. Batista F.D., Iber D., Neuberger M.S.; B cells acquire antigen from target cells after synapse formation; Nature 2001:411, 489–494
35. Qiu Y., Korteweg C., Chen Z. et al.; Immunoglobulin G expression and its colocalization with complement proteins in papillary thyroid cancer; Modern Pathology 2012:25, 36–45
36. Howie A.J.; Handbook of Renal Biopsy Pathology; Springer 2nd edition 2008, 175–182
37. Licht C., Hoppe B.; Complement defects in children which result in kidney diseases: diagnosis and therapy. In Complement and kidney disease; Edited by Zipfel PF Basel-Boston-Berlin 2006 Bikhauser Verlag: 184–197
38. Rebuffat S.A., Nguyen B., Robert B. et al.; Antiperoxidase Antibody-Dependent Cytotoxicity in Autoimmune Thyroid Disease; J. Clin. Endocrinol. Metab. 2008:93, 3, 929–934








