Endokrynol. Ped. 12/2013;1(42):83-88
DOI: 10.18544/EP-01.12.01.1444
Choroba Dühringa u dzieci z cukrzycą typu 1
Katedra i Klinika Endokrynologii i Diabetologii Wieku Rozwojowego AM we Wrocławiu
Słowa kluczowe: choroba Dühringa, celiakia, cukrzyca typu 1, zmiany skórne
Streszczenie
Opryszczkowate zapalenie skóry (dermatitis herpetiformis, DH) zostało opisane przez Louisa Dühringa w roku 1884. Jest chorobą autoimmunologiczną, w której patogenezie istotną rolę odgrywa nietolerancja glutenu. Na szczycie brodawek blisko granicy skórno-naskórkowej dochodzi do odkładania się ziarnistych złogów IgA, które wykrywa się stosując metodę immunofluorescencji bezpośredniej. Zmiany skórne o różnym typie (grudki, rumienie, niewielkie pęcherze), swędzące, układające się symetrycznie, najczęściej zlokalizowane są na łokciach i kolanach, karku, owłosionej skórze głowy oraz skórze twarzy, łopatkach, okolicy krzyżowej i pośladkach. Przedstawiamy trzech pacjentów, u których cukrzyca typu 1 współwystępowała z zapaleniem tarczycy, celiakią oraz opryszczkowatym zapaleniem skóry
Wstęp
Choroby o podłożu autoimmunologicznym mogą dotyczyć wielu narządów i często mogą ze sobą współistnieć [1]. Opryszczkowate zapalenie skóry (dermatitis herpetiformis, DH) jest chorobą autoimmunologiczną, mającą ścisły związek z nadwrażliwością na gluten i według niektórych autorów choroba określana jest jako skórna manifestacja celiakii (CD) [2].
Diagnostyka DH oparta jest na stwierdzeniu w badaniu fizykalnym charakterystycznych zmian skórnych, ocenie markerów serologicznych oraz na badaniu histopatologicznym i immunofluorescencyjnym materiału pobranego z biopsji skóry [3]. Typowymi zmianami skórnymi dla DH są pęcherzyki oraz grudki na rumieniowej podstawie. Charakterystyczną cechą kliniczną jest bardzo nasilony świąd, dlatego w wyniku drapania okolic zmienionych mogą dominować wtórne zmiany, takie jak przeczosy i nadżerki. Najczęściej zmiany zlokalizowane są symetrycznie na powierzchniach wyprostnych łokci i kolanach, w okolicy krzyżowej i na pośladkach, na twarzy oraz owłosionej skórze głowy. Bardzo podobne zmiany mogą występować w wielu innych chorobach skóry, jak np. pemfigoidzie, linijnej IgA dermatozie pęcherzowej. Badania serologiczne są cennym uzupełnieniem diagnostyki, są także pomocne w monitorowaniu aktywności choroby. DH wykazuje ścisły związek z CD.
W surowicy chorych z DH wykrywa się przeciwciała IgA skierowane przeciwko endomysium mięśni gładkich (IgAEmA) oraz przeciw transglutaminazie tkankowej (tTGA). Z odkryciem, że transglutaminaza epidermalna (eTGA) jest kluczowym autoantygenem w DH, testy serologiczne stwierdzające obecność przeciwciał eTGA mogą stanowić dobre badanie przesiewowe. Oznaczenie ich miana charakteryzuje wysoka czułość i specyficzność oraz mniejsze koszty i mniejsza inwazyjność w porównaniu do biopsji skóry.
W obrazie histopatologicznym materiału pobranego z biopsji skóry typowe dla DH są skupiska neutrofili i eozynofili na szczycie brodawek skórnych oraz okołonaczyniowy naciek zapalny. Podobny obraz histopatologiczny występuje w pęcherzycy IgA i pęcherzowym toczniu rumieniowatym. Badaniem rozstrzygającym pozostaje bezpośrednie badanie immunofluorescencyjne (direct immunofluorescence, DIF) chorobowo niezmienionej skóry na obecność złogów IgA [3]. Zarówno DH, jak i CD mają podłoże genetyczne. U osób z tymi schorzeniami stwierdza się specyficzne antygeny zgodności tkankowej w regionie HLA-DQ (DQ2 i DQ8). [2]. Podstawą terapii DH jest eliminacja glutenu z diety. Zmiany skórne wycofują się w ciągu miesięcy, do roku po wprowadzeniu diety bezglutenowej. Ustąpienie zmian skórnych można przyspieszyć, podając doustnie sulfony, takie jak dapson [3]. W pracy prezentujemy trzech pacjentów, u których cukrzyca typu 1 (DM1) współwystępowała z zapaleniem tarczycy, CD oraz DH.
Pacjent 1
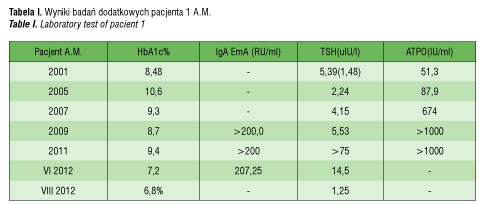
U obecnie 17-letniego chłopca w 5 roku życia rozpoznano DM1. W 6 roku życia był hospitalizowany z powodu ostrej pokrzywki z zapaleniem
stawów skokowych i kolanowych, w leczeniu stosowano Fenicort i Majamil. W badaniach dodatkowych stwierdzono nieznacznie podwyższone miano przeciwciał przeciw tyreoperoksydazie (ATPO), w badaniu USG tarczycy obraz prawidłowy. Zalecono leczenie lewotyroksyną. W 9 roku życia chłopiec był hospitalizowany w Klinice Chorób Infekcyjnych z powodu ostrego zapalenia wątroby z cholestazą (AspAT 1891 U/l; AlAT 1936 U/l; bilirubina 8,55mg/ml). Wykluczono autoimmunologiczne zapalenie wątroby (nie ustalono etiologii choroby). Zalecono diagnostykę w kierunku celiakii w ramach wizyty w Poradni Gastroenterologicznej. Po uzyskaniu dodatniego wyniku badania serologicznego w kierunku choroby trzewnej zalecono dietę bezglutenową (nie wykonano biopsji jelita). Chłopiec na kontrolne wizyty diabetologiczne zgłaszał się niesystematycznie – co dwa lata, lewotyroksynę przyjmował nieregularnie, nie przestrzegał diety bezglutenowej. W latach 2005, 2007 i 2009 hospitalizowany w Klinice Endokrynologii i Diabetologii Wieku Rozwojowego z powodu niewyrównania metabolicznego cukrzycy W 15 roku życia, z uwagi na utrzymywanie się podwyższonego miana IgAEmA, zdecydowano o wykonaniu biopsji jelita cienkiego. W badaniu histopatologicznym wycinka błony śluzowej dwunastnicy stwierdzono wyraźnie skrócone kosmki i przerost krypt jelitowych, w zrębie obecny intensywny, przewlekły naciek zapalny, obraz morfologiczny odpowiadał zanikowi III stopnia wg skali Marsha. Zalecono dietę bezglutenową. W 16 roku życia chłopiec, po rocznej przerwie, zgłosił się na wizytę kontrolną w Poradni Diabetologicznej. W wywiadzie podawał, że od około ośmiu miesięcy obserwuje zmiany skórne. W badaniu przedmiotowym na skórze wyprostnych części kończyn, pośladkach oraz głowy owłosionej na podłożu zapalnym obserwowano zmiany grudkowe, liczne przeczosy oraz nadżerki, nasilony świąd. Pacjenta skierowano do Kliniki Dermatologii, gdzie w pobranym wycinku z niezmienionej skóry pośladka, w bezpośrednim badaniu immunofluorescencyjnym, potwierdzono DH. Zalecono dietę bezglutenową oraz rozpoczęto leczenie sulfonami. Chłopiec lek przyjmuje regularnie, zmiany skórne wycofały się.
Wyniki badań dodatkowych podano w tabeli I.
Pacjent 2
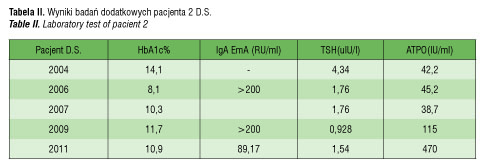
U obecnie 17-letniego chłopca w 10 roku życia rozpoznano DM1 oraz autoimmunologiczne zapalenie tarczycy (obserwowano podwyższone miano ATPO). Z uwagi na utrzymującą się eutyreozę nie wymagał leczenia lewotyroksyną. W 12 roku życia podczas badań przesiewowych w kierunku celiakii (zgodnie z zaleceniami Polskiego Towarzystwa Diabetologicznego), stwierdzono u niego wysokie miano IgAEmA (>200 RU/ml). Skierowany został do Kliniki Gastroenterologii, gdzie na podstawie wyniku biopsji jelita rozpoznano CD. Zalecono mu dietę bezglutenową. Po roku u chłopca wystąpiły zmiany skórne w obrębie twarzy, dłoni, przedramion, łokci i kolan oraz na pośladkach pod postacią licznych swędzących grudek, niektóre z nich pokryte były strupami. W Klinice Dermatologii wykonano biopsję skóry, rozpoznając DH. Na podstawie wywiadu oraz wyników badań dodatkowych można stwierdzić, że chłopiec nie przestrzega diety bezglutenowej, ponieważ zmiany skórne okresowo zaostrzają się oraz występują nieuzasadnione niedocukrzenia z neuroglikopenią włącznie, które mogą być spowodowane zaburzeniami wchłaniania jelitowego. Wyniki badań dodatkowych podano w tabeli II.
Pacjent 3
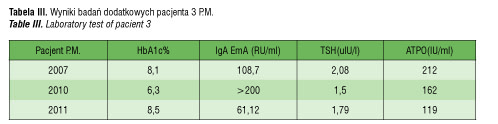
U obecnie 19-letniego pacjenta DM1 rozpoznano w 5 roku życia. W 6 roku życia był diagnozowany w Klinice Gastroenterologicznej z powodu wystąpienia bardzo obfitych stolców i braku łaknienia, w wykonanym badaniu histopatologicznym błony śluzowej jelita cienkiego nie stwierdzono cech zaniku kosmków jelitowych. W wieku 14 lat był hospitalizowany z powodu bardzo chwiejnych glikemii oraz bólów kolan. W wykonanych badaniach stwierdzono wysokie miano IgAEmA oraz ATPO. Zalecono przyjmowanie lewotyroksyny. Pacjent nie przyjmował lewotyroksyny i nie przestrzegał diety bezglutenowej, czego dowodem było utrzymywanie się w kontrolnych badaniach wysokiego miana IgAEmA. W 17 roku życia stwierdzono zmiany skórne pod postacią swędzącej wysypki drobnogrudkowej na łokciach, kolanach i pośladkach. DH została potwierdzona badaniem immunofluorescencyjnym bioptatu skóry, w którym stwierdzono drobnoziarniste złogi IgA w szczytach brodawek skórnych. Wyniki badań dodatkowych podano w tabeli III.
Omówienie
Do najczęstszych chorób autoimmunologicznych obserwowanych w populacji wieku rozwojowego należą DM1, CD oraz autoimmunologiczne choroby tarczycy [1]. Według Kaukinen i wsp. u osób, u których występują co najmniej dwie choroby o podłożu autoimmunologicznym, ryzyko zachorowania na celiakię wynosi 10% [4]. Według ISPAD (International Society for Pediatric and Adolescent Diabetes) u dzieci i młodzieży chorych na cukrzycę typu 1 częstość występowania CD wynosi od 1 o 10%, a autoimmunologiczne zapalenie tarczycy typu Hashimoto występuje u 3–8% [5]. Obecnie choroby te u osób z DM1 są rozpoznawane w okresie klinicznie bezobjawowym, ponieważ zgodnie z zaleceniami PTD dla pacjentów z DM1 zaleca się wykonywanie badań przesiewowych w kierunku CD oraz chorób tarczycy co 1–2 lata.
DM1 może również współwystępować z dermatologicznymi chorobami o podłożu autoimmunologicznymi, takimi jak bielactwo, łysienie plackowate czy DH.U prezentowanych pacjentów pierwszą zdiagnozowaną chorobą autoimmunologiczną była DM1, natomiast chorobę Hashimoto oraz CD rozpoznano w oparciu o badania przesiewowe w późniejszym czasie. Podkreśla się, że jedynym objawem CD u osób z DM1 może być występowanie nieuzasadnionych epizodów hipoglikemii, które obserwowaliśmy u jednego z naszych pacjentów. DH i CD mają podobną patogenezę, a w niektórych przypadkach mogą współistnieć. W DH i CD występują te same markery serologiczne, a pierwotnym autoantygenem, przeciwko któremu kierowane są przeciwciała w DH, jest eTGA. W diagnostyce serologicznej CD wykorzystywane są przede wszystkim oznaczenia IgAEmA oraz przeciwko tTGA, które ocenia się najczęściej w klasie IgA. Z uwagi na często występujący niedobór immunologlobuliny IgA konieczne jest oznaczenie jej miana. U pacjentów z niedoborem IgA badanie przesiewowe w kierunku CD należy wykonać w klasie IgG. U pacjentów z DH nie odnotowano niedoboru IgA, dlatego autorzy uważają, że immunoglobulina ta może brać udział w powstawaniu zmian skórnych [3].
Transglutaminazy są grupą enzymów pełniących wiele fizjologicznych funkcji [6]. Wysunięto hipotezę reakcji krzyżowej przeciwciał przeciw tranglutaminazie z różnymi enzymami należącymi do tej samej rodziny. Mogłoby to wyjaśnić różną manifestację kliniczną DH i CD. U osób z rozpoznaną DH przeciwciała IgA EmA obecne są u 70–80% chorych, a IgA tTGA u 70–90%. Z kolei u osób z CD można stwierdzić obecność nie tylko IgA tTGA i IgA EmA, ale także IgAe TGA [7].
CD najczęściej ujawnia się w okresie dzieciństwa, natomiast objawy kliniczne DH manifestują się w wieku późniejszym [2]. U prezentowanych pacjentów zmiany skórne wystąpiły kilka lat po zdiagnozowaniu CD.Chłopcy nie przestrzegali zaleceń dietetycznych. Badacze sugerują, że przyczyną zmian skórnych u osób z celiakią może być zjawisko wewnątrzcząsteczkowego rozprzestrzeniania się epitopów w obrębie transglutaminaz, prowadzące do powstania przeciwciał o dużym powinowactwie do eTG [8].
Wnioski
1. DH jest chorobą autoimmunologiczną, która może współwystępować z DM1 i CD.
2. Jednym z czynników ryzyka ujawnienia się DH może być nieprzestrzeganie zaleceń diety bezglutenowej u dzieci z CD.
3. Zmiany skórne u dzieci z DM1 o charakterystycznej lokalizacji, przebiegające ze świądem, wymagają uwagi i diagnostyki w kierunku DH.
Piśmiennictwo
1. Szalecki M.; Współistnienie cukrzycy i innych chorób autoimmunologicznych; Przegląd Pediatryczny 2009:39, 4, 260-265
2. Bolotin D., Petronic-Rosic V.; Part I. Dermatitis herpetiformis. Epidemiology, pathogenesis, and clinical presentation; J. Am. Acad. Dermatol. 2011 Jun:64(6), 1017-1024
3. Bolotin D., Petronic-Rosic V.; Dermatitis herpetiformis. Diagnosis, management, and prognosis; J. Am. Acad. Dermatol. 2011 Jun:64(6), 1027-1033
4. Kaukinen K., Collin P., Mykkanen A.H. et al.; Celiac disease and autoimmune endocrinologic disorders; Dig. Dis. Sci. 1999:44, 1428-1433
5. Kordonouri O., Maguire A.M., Knip M. et al.; Other complications and associated conditions with diabetes in children and adolescents; ISPAD Clinical Practise Consensus Guidelines 2009 Compendium
6. Wolnik-Trzeciak G., Bowszyc-Dmochowska M., Dańczak-Pazdrowska A., Dmochowski M.:; Budowa i czynności transglutaminaz oraz ich rola w opryszczkowatym zapaleniu skóry; Dermatologia Kliniczna 2005:7(1), 37-43
7. Wolnik-Trzeciak G., Bowszyc-Dmochowska M., Dańczak-Pazdrowska A., Dmochowski M.; Przeciwciała IgA przeciwko naskórkowej i tkankowej transglutaminazie oraz śródmięsnej a typy skórnych złogów IgA w opryszczkowatym zapaleniu skóry; Dermatologia Kliniczna 2005:7(2), 61-65
8. Rose C., Bröcker E.B., Zillikens D.; Clinical, histological and immunpathological findings in 32 patients with dermatitis herpetiformis Duhring; J. Dtsch. Dermatol. Ges. 2010 Apr:8(4), 265-270








