Endokrynol. Ped. 12/2013;1(42):37-44
DOI: 10.18544/EP-01.12.01.1439
Nieukarboksylowana postać osteokalcyny jako pośredni wskaźnik zaopatrzenia w witaminę K dziewcząt w różnych stadiach pokwitania
Zakład Propedeutyki Pediatrii, Uniwersytet Medyczny w Lublinie
Słowa kluczowe: nieukarboksylowana osteokalcyna, metabolizm kostny, witamina K, dziewczęta, pokwitanie
Streszczenie
Wstęp. Witamina K bierze udział w γ-karboksylacji reszt glutaminowych (Glu) osteokalcyny. W postaci nieukarboksylowanej osteokalcyna nie ma dostatecznej zdolności do wiązania wapnia w kryształach hydroksyapatytu, zewnątrzkomórkowej macierzy kostnej. Uważa się, że stężenie nieukarboksylowanej osteokalcyny (ucOC) odzwierciedla stężenie witaminy K we krwi. Celem niniejszej pracy jest określenie stężenia osteokalcyny i ucOC w surowicy dziewcząt w różnych stadiach pokwitania. Materiał i metody. Badaniami objęto 133 zdrowe dziewczęta w wieku od 11,8 do 13,7 lat, których rozwój oceniano dwukrotnie w odstępie 6 miesięcy. Określano tempa wzrastania i nasilenie procesu kościotworzenia, mierząc stężenie N-końcowego propeptydu prokolagenu typu I (PINP) w surowicy. Wyniki. Dziewczęta przed menarche (w II i III stadium pokwitania) miały istotnie wyższe średnie przyrosty wysokości ciała i średnie stężenie PINP niż dziewczęta po menarche (stadium IV). Stężenie osteokalcyny w surowicy było wyższe u dziewcząt w stadium II niż u dziewcząt w stadium IV, ale stężenie ucOC nie różniło się między grupami. Podobny był też %ucOC. Wnioski. Stężenie nieukarboksylowanej osteokalcyny w surowicy, w odróżnieniu od stężenia osteokalcyny, nie zależy od stadium pokwitania dziewcząt. Stężenia ucOC jak też %ucOC nie wskazują na niedobór witaminy K u badanych dziewcząt
Wstęp
Witamina K nie jest substancją jednorodną, a grupą związków chemicznych będących pochodnymi 2-metylo-1,4-naftochinonu. Dla człowieka źródłem witaminy K jest dieta roślinna i flora bakteryjna przewodu pokarmowego. Dieta dostarcza witaminę K1 (filochinon), która występuje w dużych stężeniach w zielonych warzywach i olejach roślinnych. Bakterie przewodu pokarmowego syntetyzują witaminę K2 (menachinon), która obecna jest również w mięsie i sfermentowanych produktach sojowych. Organizm ludzki nie jest zdolny do syntezy witaminy K. Tymczasem jej niedobór może spowodować groźne dla życia krwawienia. Przykładem mogą być karmione mlekiem matki noworodki i niemowlęta w pierwszym kwartale życia, które nie otrzymują profilaktycznie witaminy K. Grozi im choroba krwotoczna, w której przebiegu obserwowane są krwawienia do skóry z przewodu pokarmowego, ale najgroźniejsze ze względu na późniejsze konsekwencje są krwawienia do ośrodkowego układu nerwowego.
W ostatnim dziesięcioleciu odkryto nową rolę witaminy K. Okazało się, że może ona brać udział w metabolizmie kostnym. Zarówno w procesie krzepnięcia, jak i w metabolizmie kostnym witamina K jest niezbędna do tworzenia aktywnych form zależnych od niej białek. Uczestniczy ona w potranslacyjnej modyfikacji białek, która polega na γ-karboksylacji reszt glutaminowych (Glu), w czego efekcie powstają reszty kwasu γ-karboksyglutaminowego (Gla), mające powinowactwo do jonów wapnia. Białka te noszą nazwę białek Gla. Należą do nich białka układu krzepnięcia, a także osteokalcyna i osteopontyna [1–4].
Osteokalcyna jest niekolagenowym białkiem o masie cząsteczkowej 5kDa, zbudowanym z 49 aminokwasów, syntetyzowanym przez dojrzałe osteoblasty i osteocyty. Uważa się, że bierze ona udział w mineralizacji kości. Jej stężenie we krwi uznawane jest za jeden ze wskaźników kościotworzenia [5]. Karboksylowana postać osteokalcyny posiada trzy reszty kwasu γ-karboksyglutaminowego (γ-carboxylated osteocalcin, Gla-OC), przez co ma duże powinowactwo do jonów wapnia. Jony te wiązane są w kryształach hydroksyapatytu, zewnatrzkomórkowej macierzy kostnej. Nieukarboksylowana forma osteokalcyny (undercarboxylated osteocalcin, Glu-OC) ma mniej niż trzy reszty kwasu γ-karboksyglutaminowego, stąd jej powinowactwo do jonów wapnia i zdolność do mineralizacji jest mniejsza. Schemat różnych form osteokalcyny przedstawia rycina 1. Karboksylowana jak i nieukarboksylowana forma osteokalcyny znajdowane są głównie w kościach, w znacznie mniejszej ilości we krwi [6]. Uważa się, że stężenie nieukarboksylowanej osteokalcyny we krwi odzwierciedla stężenie witaminy K. U dorosłych, stężenie nieukarboksylowanej osteokalcyny obniża się w odpowiedzi na suplementację witaminy K [7, 8].

Celem niniejszej pracy było określenie stężenia osteokalcyny i nieukarboksylowanej formy osteokalcyny u dziewcząt w różnych stadiach pokwitania w odniesieniu do ich tempa wzrastania i nasilenia procesu kościotworzenia, mierzonego stężeniem N-końcowego propeptydu prokolagenu typu I (PINP) w surowicy.
Materiał i metody
Badaniami objęto 133 dziewczęta w wieku od 11,8 do 13,7 lat. Dziewczęta badano dwukrotnie (w marcu i we wrześniu, w odstępie sześciu miesięcy) w szkolnym gabinecie lekarskim. Każdorazowo oceniano stan ich zdrowia, zbierając dokładny wywiad lekarski i przeprowadzając badanie fizykalne. Określano cechy somatyczne badanych, takie jak masa i wysokość ciała. Obliczano wskaźnik masy ciała (BMI). Dojrzałość płciową dziewcząt oceniano według skali Tannera, stężenia estradiolu w surowicy krwi i wywiadu odnośnie do menarche. Krew, celem wykonania badań biochemicznych, pobierano z żyły łokciowej w godzinach rannych (pomiędzy 08.00 a 10.00) w czasie pierwszej wizyty. Po wykrzepieniu krew odwirowywano, a otrzymaną surowicę zamrażano do temp. -80ºC do czasu wykonania oznaczeń biochemicznych.
W surowicy krwi metodą radioimmunologiczną oznaczano stężenie: estradiolu (E2-RIA-CT, BioSource Europe SA, Belgium), N-końcowego propeptydu prokolagenu typu I (PINP RIA, Orion Diagnostica, Finland) oraz osteokalcyny (hOST-IRMA, BioSource SA, Belgium). Stężenie nieukarboksylowanej formy osteokalcyny oznaczano metodą ELISA (GLU-OC EIA Kit, Takara Biomedical Group, Japan).
Po sprawdzeniu hipotezy zerowej o normalnym rozkładzie zmiennych istotność różnic pomiędzy średnimi wartościami cech antropometrycznych i parametrów biochemicznych w analizowanych grupach oceniano stosując test Manna-Whitneya (nieparametryczny test dla zmiennych niepowiązanych). Istotności różnic w obrębie tej samej grupy sprawdzano stosując test Wilcoxona (nieparametryczny test dla zmiennych powiązanych). Zależności między badanymi parametrami oceniano na podstawie współczynnika korelacji rang Spearmana. Przyjęto poziom istotności p=0,05.
Wyniki badań
Wszystkie dziewczęta były w okresie pokwitania, przy czym 101 było przed menarche a 32 po menarche. Dziewczęta po menarche były w czwartym stadium pokwitania, dziewczęta przed menarche w stadium drugim i trzecim. Zgodnie z oczekiwaniami dziewczęta przed menarche były lżejsze, niższe, miały mniejszy wskaźnik masy ciała (BMI) i niższe stężenia estradiolu, ale średnie przyrosty wysokości ciała i średnie stężenie PINP były u nich wyższe niż u dziewcząt po menarche. Porównując dziewczęta w stadium II z dziewczętami w stadium III okazało się, że te ostatnie są cięższe, mają większe BMI i wyższe stężenie estradiolu w surowicy krwi, ale wysokość ciała, przyrosty wysokości, stężenia PINP, osteokalcyny i nieukarboksylowanej osteokalcyny w obu grupach są podobne (tab. 1 i 2).
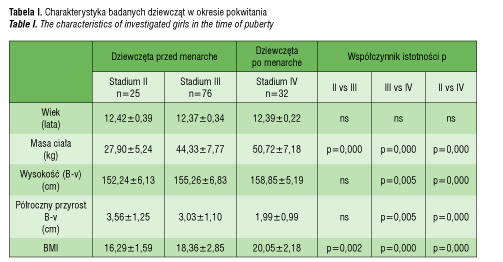
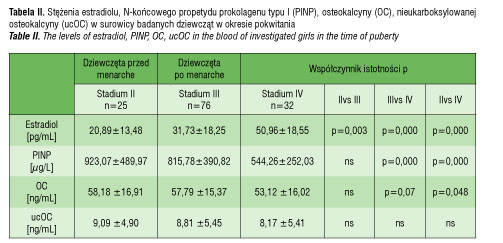
O ile stężenie osteokalcyny u dziewcząt w stadium IV było istotnie niższe niż u dziewcząt w stadium II i niemal istotnie niższe niż u dziewcząt
w stadium III, to stężenie ucOC nie różniło się między grupami. Obliczając jaką część całkowitej osteokalcyny stanowi osteokalcyna nieukarboksylowana, ustalono, że jest to 15,62% u dziewcząt w stadium drugim, 15,24% u dziewcząt w stadium trzecim i 15,38% u dziewcząt w stadium czwartym. Tak więc wielkości odsetkowe nie różnią się między grupami.
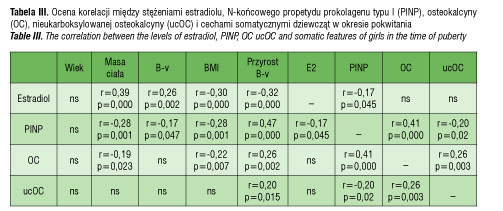
Analizując zależności między badanymi parametrami (tab. III) stwierdzono, że istnieją wysoce dodatnie korelacje między stężeniem PINP a przyrostem wysokości ciała (r=0,47; p=0,000) oraz słabe dodatnie korelacje między: stężeniem osteokalcyny i osteokalcyny nieukarboksylowanej (r=0,26; p=0,003), stężeniem osteokalcyny czy stężeniem ucOC a przyrostem wysokości ciała (odpowiednio: r=0,26; p=0,002 oraz r=0,20; p=0,015). Dodatnia jest również korelacja między stężeniem PINP a stężeniem OC (r=0,41; p<0,000), ale korelacja między stężeniem PINP i stężeniem ucOC jest ujemna (r=-0,20; p<0,02).
Dyskusja
Powszechnie uważa się, że okres dzieciństwa i młodzieńczy to czas gromadzenia masy kostnej, a wielkość nagromadzonej masy może mieć znaczenie w rozwoju osteoporozy w wieku starczym. Najbardziej naturalna regulacja procesu gromadzenia się masy kostnej w okresie dzieciństwa i młodości powinna polegać na właściwie dobranej diecie i aktywności fizycznej. Niezaprzeczalnym dowodem na prawdziwość takiego rozumowania jest fakt pozytywnego wpływu na kości dostarczanych w diecie wapnia i witaminy D. Przypuszcza się, że istotne znaczenie ma również odpowiednia podaż witaminy K. Nawet niedoborowa dieta pokrywa zapotrzebowanie dzienne na witaminę K na tyle, aby zapewnić utrzymanie prawidłowych parametrów układu krzepnięcia. Z niektórych badań wynika, że stężenie witaminy K wystarczające do utrzymania hemostazy może być za niskie, aby zapewnić prawidłowy metabolizm kostny. Dowodzą one, że niedobór witaminy K przyczynia się do zmniejszenia mineralnej masy kostnej (BMD) i zwiększenia ryzyka złamań kości u pacjentów z osteoporozą. Natomiast zwiększenie spożycia witaminy K może zapobiegać złamaniom z powodu osteoporozy [9]. Korzyści wynikające z suplementacji witaminy K, w postaci zmniejszenia tempa utraty masy kostnej lub wręcz jej zwiększenia, obserwowano u kobiet w okresie postmenopauzalnym [10]. Zaopatrzenie w witaminę K oceniano poprzez określanie stężenia filochinonu (ang. phylloquinone) we krwi i pośrednio mierząc stężenie nieukarboksylowanej osteokalcyny (ucOC) [9].
Celem niniejszej pracy było określenie stężenia osteokalcyny i nieukarboksylowanej osteokalcyny u dziewcząt w różnych stadiach pokwitania w odniesieniu do ich tempa wzrastania i nasilenia procesu kościotworzenia. Od dawna zauważono, że dzieci i młodzież mają wyższe stężenia OC niż dorośli, co jest spowodowane intensywniejszym metabolizmem kostnym [11]. Obserwowane przez nas dziewczęta będące w drugim stadium pokwitania miały większe przyrosty wysokości ciała niż te będące w stadium czwartym. Wyższe były też u nich stężenia N-końcowego propeptydu prokolagenu typu I, będącego wskaźnikiem syntezy kolagenu typu I (jedynego kolagenu występującego w kościach) oraz osteokalcyny. Tymczasem stężenia ucOC nie różniły się istotnie między grupami.
Badania dotyczące związku karboksylowanych form osteokalcyny z metabolizmem i dobrostanem kości u dzieci nie są liczne. Pierwsza praca pochodzi z roku 2004, a jej autorami są Kalkwarf i wsp. [12]. Badano zależności między spożyciem witaminy K1 i zawartością mineralną kości (BMC) u zdrowych dziewcząt amerykańskich. Dziewczęta były w wieku od trzech do szesnastu lat. Zasoby witaminy K określano na podstawie stężenia filochinonu i ucOC w plazmie krwi. Badania trwały 36 miesięcy i polegały na systematycznej analizie składników diety, pomiarach BMC, masy i wysokości ciała oraz ocenie dojrzałości płciowej dziewcząt. Autorzy nie stwierdzili zależności między dawką filochinonu zawartą w diecie a jego stężeniem we krwi czy stężeniem wskaźników metabolizmu kostnego. Autorzy wykazali dodatnią zależność między stężeniem filochinonu a %ucOC oraz ujemną zależność między stężeniem filochinonu a stężeniem osteokalcyny w plazmie. Co więcej, zauważyli, że wzrost koncentracji witaminy K w plazmie wiązał się ze zmniejszeniem stężenia NTx (bez wpływu na stężenie fosfatazy alkalicznej), a wzrost %ucOC ze wzrostem stężenia NTx. Autorzy nie wykazali wyraźnych zależności między spożyciem czy stężeniem witaminy K we krwi a BMC, jak również między %ucOC a BMC. Reasumując stwierdzili, że lepsze zaopatrzenie w witaminę K, wyrażone jako wyższe stężenie filochinonu w plazmie i niższy %ucOC, wiąże się z niższymi stężeniami wskaźników kościotworzenia i resorpcji kostnej. Nie znaleźli też wystarczających dowodów na to, żeby stwierdzić, że większe spożycie witaminy K i większe jej stężenie we krwi zwiększają masę kostną u dzieci i młodzieży. Wręcz wykazali, że lepszy status witaminy K, wyrażony jako niski %ucOC, wiąże się ze zmniejszeniem metabolizmu kostnego, a wyższe ucOC wiąże się ze wzrostem metabolizmu kostnego i mniejszą zawartością mineralną kości u młodych dziewcząt.
Późniejsze badania, przeprowadzone wśród zdrowych dzieci europejskich, zaprzeczyły tym stwierdzeniom. W roku 2007 van Summeren i wsp. [13], przeprowadzając badania przekrojowe wśród zdrowych dziewcząt i chłopców holenderskich w wieku od 3 do 18 lat oraz wśród zdrowych dorosłych ochotników w wieku od 25 do 35 lat, stwierdzili korzystny wpływ witaminy K na metabolizm kostny. Zasoby witaminy K w organizmie oceniano pośrednio, biorąc pod uwagę stężenia ucOC i oOC w surowicy, co dało podstawę do obliczenia wskaźnika UCR (stosunek ucOC do oOC). Podwyższony UCR wiązano z niższym zaopatrzeniem w witaminę K. Metabolizm kostny oceniany był na podstawie stężenia frakcji kostnej fosfatazy alkalicznej (BAP) będącej wskaźnikiem kościotworzenia oraz usieciowanego N- końcowego telopeptydu kolagenu typu I (NTX) będącego wskaźnikiem kościogubienia. Wykazano, podobnie jak w badaniach własnych, istotne statystycznie różnice między stężeniami wskaźnika kościotworzenia w zależności od stadium pokwitania. W II–IV stadium wskaźnik ten był istotnie wyższy niż w stadium V. Stężenia ucOC i wskaźnik UCR u dzieci były znacznie wyższe niż u dorosłych, przy czym najwyższe były w stadiach II–IV. Wysoki UCR u dzieci w okresie pokwitania autorzy interpretują jako efekt niedostatecznego zaopatrzenie kości w witaminę K. W badaniach własnych stwierdzono, że już dziewczęta w stadium IV mają niższe stężenia wskaźników kościotworzenia niż dziewczęta w stadium II i III, co wynika z mniejszego tempa wzrastania, ale stężenia ucOC, a także %ucOC nie różniły się istotnie między grupami.
W rok po pierwszej publikacji van Summeren i wsp. [14] opublikowali wyniki kolejnego badania, które tym razem dotyczyło dzieci w wieku 8–14 lat (średnio: 11,2 lat ). Oprócz stężeń frakcji kostnej fosfatazy alkalicznej (BAP) i wskaźnika resorpcji kostnej, C-końcowego telopeptydu kolagenu typu I (ICTP) oznaczano również stężenie PINP w surowicy. Wykazano, że wskaźnik UCR wzrasta w miarę osiągania wyższych stadiów dojrzałości płciowej i jest dodatnio skorelowany z masą ciała, BMI a także ze stężeniem BAP, PICP i ICTP. Nasze wyniki wskazują, że zachodzi dodatnia korelacja między stężeniem OC i PINP, między stężeniem ucOC i PINP, a także między stężeniem ucOC i osteokalcyny, ale korelacja między stężeniem ucOC i PINP jest ujemna.
Oceną wpływu witaminy K na metabolizm kostny zajmowali się także O’Connor i wsp. [15]. Obiektem ich badań były zdrowe dziewczęta duńskie w wieku 11–12 lat. Podobnie jak w naszym badaniu, mierzono ich masę i wysokość ciała oraz oceniano stopień dojrzałości płciowej (wg skali Tannera).
W surowicy krwi oznaczano stężenie osteokalcyny całkowitej oraz ucOC, a następnie obliczano %ucOC. Ponadto oceniano zawartość BMC i oraz wskaźniki metabolizmu kostnego w moczu, takie jak pyridinolina (Pyr) i deoxypyridinolina (Dpyr). Stwierdzono, że stężenie osteokalcyny w surowicy nie korelowało z %ucOC, korelowało natomiast dodatnio ze stężeniem Pyr i Dpyr. Korelacja między %ucOC a BMC była ujemna. Na podstawie przeprowadzonych badań autorzy pracy wysunęli wniosek, że lepsze zaopatrzenie w witaminę K, wyrażone mniejszym %ucOC, przyczynia się do zwiększenia mineralnej zawartości kości u dziewcząt w wieku 11–12 lat. Różnice między wynikami badań uzyskanymi przez Kalkwarf i wsp. [12] oraz O’Connor i wsp. [15] można tłumaczyć tym, że badane dzieci były w różnym wieku i o różnej dojrzałości biologicznej. Godny uwagi jest fakt, że wyniki pomiaru stężeń ucOC miały duży rozrzut, co może świadczyć o zmiennościach indywidualnych w jego tworzeniu się pod wpływem witaminy K. Z ostatnich badań wynika, że synteza funkcjonalnej osteokalcyny zależy nie tylko od witaminy K, ale też od witaminy D. Dwunastomiesięczna suplementacja witaminą D duńskich dziewcząt w wieku od 11 do 12 lat spowodowała, że stężenie ucOC w grupie suplementowanej było niższe niż w grupie otrzymującej placebo [16].
Reasumując, na postawie prac van Summeren i wsp. [13,14] oraz O’Connor i wsp. [15,16] można wnioskować, że witamina K sprzyja mineralizacji kości. Pośrednim wskaźnikiem zaopatrzenia w witaminę K jest stężenie ucOC i %ucOC. Im wyższy jest %ucOC, tym zaopatrzenie w witaminę K jest niższe. O’Connor i wsp. [15] dokonali oceny %ucOC u badanych przez siebie dzieci i stwierdzili, że mediana tego parametru wynosi 21,9%, co jest wartością relatywnie wysoką, ale mieści się w zakresie wartości podawanych przez innych autorów. Z badań Kalkwarf i wsp. [12] wynika, że u zdrowych dzieci amerykańskich %ucOC wynosi 13,6. Powołując się na niepublikowane dane O’Connor i wsp. [15] podają, że u dzieci irlandzkich jest to 33,9%. U badanych przez nas dziewcząt %ucOC wynosi poniżej 16 i nie różni się w zależności od stadium pokwitania. Należy przy tym zaznaczyć, że wartość ta może być niedokładna, zważywszy na zastosowanie różnych metod oznaczania stężenia OC i ucOC. Z tych samych względów z dużą ostrożnością należy porównywać wyniki innych autorów między sobą.
Wnioski
1. Stężenie nieukarboksylowanej osteokalcyny, w odróżnieniu od stężenia osteokalcyny, nie zależy od stadium pokwitania dziewcząt.
2. Wielkość odsetkowa nieukarboksylowanej osteokalcyny (%ucOc) we krwi nie wskazuje na niedobór witaminy K w badanej populacji dziewcząt.
3. Odpowiedź na pytanie, czy dzieci wymagają dodatkowej podaży witaminy K, aby poprawić jakość kości, będzie możliwa po przeprowadzeniu dobrze zaplanowanych badań randomizowanych z podaniem witaminy K.
Podziękowania
Dziękujemy pani antropolog dr n. przyr. Marii Kozłowskiej za pomoc w ocenie rozwoju somatycznego i płciowego badanych dziewcząt.
Piśmiennictwo
1. Vermeer C., Braam L.; Role of K vitamins in the regulation of tissue calcification; J. Bone Miner. Metab. 2001:19, 201-206
2. Wallin R., Sane D.C., Hutson S.M.; Vitamin K 2,3-epoxide reductase and the vitamin K-dependent g-carboxylation system; Thromb. Res. 2003:108, 221-226
3. Rubinacci A.; Expanding the functional spectrum of vitamin K in bone. Focus on: “Vitamin K promotes mineralization, osteoblast to osteocyte transition, and an anti-catabolic phenotype by {gamma}-carboxylation-dependent and -independent mechanisms”; Am. J. Physiol. Cell Physiol. 2009:297(6), C1336-8
4. Berkner K.L.; Vitamin K-dependent carboxylation; Witam. Horm. 2008:78, 131-156
5. Neve A., Corrado A., Cantatore F.P.; Osteoblast physiology in normal and pathological conditions; Cell Tissue Res. 2011:343(2), 289-302
6. Cairns J.R., Price P.A.; Direct demonstration that the vitamin K-dependent bone Gla protein is incompletely gamma-carboxylated in humans; J. Bone Miner. Res. 1994:9(12), 1989-1997
7. Binkley N.C., Krueger D.C. et al.; Vitamin K supplementation reduces serum concentrations of under-γ-carboxylated osteocalcin in healthy young and elderly adults; Am. J. Clin. Nutr. 2000:72, 1523-1528
8. Gundberg C.M., Lian J.B., Booth S.L.; Vitamin K-dependent carboxylation of osteocalcin: friend or foe?; Adv. Nutr. 2012:3(2), 149-157
9. Booth S.L., Dallal G., Shea M.K. et al.; Effect of vitamin K supplementation on bone loss in elderly men and women; J. Clin. Endocrinol. Metab. 2008:93, 1217-1223
10. Braam L.A., Knapen M.H., Geusens P. et al.; Vitamin K1 supplementation retards bone loss in postmenopausal women between 50 and 60 years of age; Calcif. Tissue Int. 2003:73(1), 21-26
11. Cioffi M., Molinari A.M., Patrizia Gazzerro P. et al.; Serum osteocalcin in 1634 healthy children; Clinical Chemist. 1997:43, 543-545
12. Kalkwarf H.J., Khoury J.C., Bean J., Elliot J.G.; Vitamin K, bone turnover, and bone mass in girls; Am. J. Clin. Nutr. 2004:80(4), 1075-1080
13. van Summeren M., Braam L., Noirt F. et al.; Pronounced elevation of undercarboxylated osteocalcin in healthy children; Pediatr Res. 2007:61(3), 366-370
14. Van Summeren M.J., van Coeverden S.C., Schurgers L.J. et al.; Vitamin K status is associated with childhood bone mineral content; Br. J. Nutr. 2008:100(4), 852-858
15. O’Connor E., Mølgaard C., Michaelsen K.F. et al.; Serum percentage undercarboxylated osteocalcin, a sensitive measure of vitamin K status, and its relationship to bone health indices in Danish girls; Br. J. Nutr. 2007:97(4), 661-666
16. O’Connor E., Mølgaard C., Michaelsen K.F. et al.; Vitamin D-vitamin K interaction: effect of vitamin D supplementation on serum percentage undercarboxylated osteocalcin, a sensitive measure of vitamin K status, in Danish girls; Br. J. Nutr. 2010:104(8), 1091-1095
17. Lian J.B., Stein G.S., Stewart C. et al.; Osteocalcin: characterization and regulated expression of the rat gene; Connect Tissue Res. 1989:21(1-4), 61-68; discussion 69
18. Collins A., Cashman K.D., Kiely M.; A preliminary assessment of vitamin K1 intakes and serum undercarboxylated osteocalcin levels in 11-13 year old Irish girls; Int. J. Vitam. Nutr. Res. 2006:76(6), 385-390








