Endokrynol. Ped. 11/2012;4(41):9-16
DOI: 10.18544/EP-01.11.04.1424
Korzystna dynamika zmian subpopulacji komórek dendrytycznych u dzieci z cukrzycą typu 1 w czasie stosowania analogu witaminy D
1Klinika Endokrynologii i Diabetologii Dziecięcej, Uniwersytet Medyczny w Lublinie
2Katedra i Zakład Immunologii Klinicznej, Uniwersytet Medyczny w Lublinie
Słowa kluczowe: cukrzyca typu 1, komórki dendrytyczne, witamina D
Streszczenie
Wstęp. Cukrzyca typu 1 jest chorobą o podłożu autoimmunizacyjnym, w której w inicjacji jak i modulowaniu odpowiedzi immunologicznej skierowanej przeciwko antygenom komórek β wysp trzustkowych ważną rolę odgrywają m.in. komórki dendrytyczne (DC). Celem naszego badania była ocena krążących komórek dendrytycznych mieloidalnych (mDC) i plazmacytoidalnych (pDC) u dzieci z cukrzycą typu 1 przed i po roku stosowania analogu witaminy D3 (Alfadiol) w obu badanych grupach oraz porównując do grupy dzieci zdrowych. Materiał i metody. Badaniami objęto grupę 90 dzieci w wieku średnio 8,75 ± 3,13 lat ze świeżo rozpoznaną cukrzycą typu 1, które losowo włączono do 2 grup (otrzymujących analog witaminy D3 lub nie) i poddano rocznej obserwacji. U wszystkich dzieci oceniono dwukrotnie poziom 25(OH) D3, c-peptydu oraz przeciwciała a-GAD i a-IA2 oraz badane populacje komórek przy pomocy cytometrii przepływowej. Grupę odniesienia stanowiło 15 zdrowych dzieci. Analizowano odsetek niedojrzałych DC mieloidalnych BDCA-1+/CD19- i plazmacytoidalnych BDCA-2+/CD123+. Wyniki. U 72% dzieci, które otrzymywały Alfadiol, oraz u 50% bez Alfadiolu stwierdzono wzrost lub utrzymywanie się wartości c-peptydu w ciągu rocznego monitorowania w porównaniu z wartościami wyjściowymi. We krwi dzieci chorych na cukrzycę typu 1 nieotrzymujących Alfadiolu stwierdzono średni odsetek mieloidalnych DCs wynoszący 0,79% i istotnie wyższy (p<0,05) niż w grupie dzieci zdrowych (0,26%). Natomiast nie stwierdzono różnic dotyczących odsetka komórek BDCA1+ pomiędzy grupą otrzymującą Alfadiol a grupą kontrolną. Odsetek komórek plazmacytoidalnych nie różnił się istotnie pomiędzy badanymi grupami. Przeanalizowano dynamikę zmian odsetka badanych subpopulacji DC w relacji do stanu wyjściowego (świeżo rozpoznana cukrzyca). Wnioski. Wykazane różnice analizowanych parametrów i populacji komórek układu immunologicznego zachęcają do bardziej szczegółowej analizy zaobserwowanych zależności, bowiem wydają się wskazywać na pewne pozytywne elementy stosowanego analogu witaminy D3 u dzieci z cukrzycą typu 1
Wstęp
Cukrzyca typu 1 jest chorobą o podłożu autoimmunizacyjnym, w której odpowiedź immunologiczna skierowana przeciwko antygenom komórek β wysp trzustkowych doprowadza do ich zniszczenia i bezwzględnego niedoboru insuliny. W jej patogenezie biorą udział czynniki genetyczne [1] i immunologiczne, począwszy od zaburzenia centralnych mechanizmów autotolerancji [2] poprzez aktywację komórek dendrytycznych (DC) , które w lokalnych węzłach chłonnych aktywują autoreaktywne limfocyty T [3,4], do zaburzenia immunoregulacji ze strony limfocytów T regulatorowych (Treg) [5].
Przeprowadzone liczne badania oceniają immunomodulacyjne właściwości witaminy D i jej analogów, podejmowane są próby wykorzystania preparatów witaminy D w prewencji i leczeniu chorób o podłożu autoimmunologicznym, m.in. cukrzycy typu 1 [6–8]. Aktywna forma witaminy D3 (1,25(OH)2D3) wywiera działanie immunomodulacyjne poprzez swoiste receptory jądrowe (VDR) obecne w wielu komórkach układu odpornościowego (makrofagi, komórki dendrytyczne, aktywowane LT i LB) [9–12].
Komórki dendrytyczne (DC) uważane są za wyspecjalizowane komórki prezentujące antygen. Ich rolą jest • aktywacja zarówno odpowiedzi komórkowej, jak i humoralnej • indukcja odpowiedzi przeciwwirusowej, bakteryjnej, nowotworowej • indukcja tolerancji immunologicznej • cytotoksyczność? Tworzą heterogenną grupę komórek od prekursorowych stwierdzanych w szpiku, niedojrzałych DC – w narządach nielimfatycznych, poprzez migrujące DC – obecne w limfie i krwi oraz dojrzałe DC – stwierdzane w narządach limfatycznych. Komórki dendrytyczne dostępne badaniom we krwi obwodowej różnią się fenotypem oraz funkcją. Wyróżnia się komórki dendrytyczne mieloidalne (mDC) o fenotypie: BDCA1+, BDCA3+, CD11c+, CD13+, CD33+, plazmacytoidalne (pDC)o fenotypie: BDCA2+, BDCA4+, CD4+, CD10+, CD123+, CD11c- oraz grudkowe [13].
Celem pracy był ocena krążących komórek dendrytycznych mieloidalnych (mDC) i plazmacytoidalnych (pDC) u dzieci z cukrzycą typu 1 przed i po roku stosowania analogu witaminy D3 (Alfadiol-Alfakalcidol) w porównaniu do grupy dzieci zdrowych.
Materiał i metody
Grupę badawczą stanowiło 90 dzieci w wieku 2–17 lat (średnia 8 8/12) ze świeżo rozpoznaną cukrzycą typu 1. Losowo zakwalifikowano je do
2 grup: 43 dzieci otrzymujących analog witaminy D3 oraz 47 nieotrzymujących analogu witaminy D3. Materiał biologiczny pobierano po wyprowadzeniu z ketozy i uzyskaniu względnego wyrównania glikemii (1–2 tydzień po rozpoznaniu cukrzycy) oraz po roku obserwacji. Grupę kontrolną stanowiło 15 zdrowych rówieśników.
Wszystkie osoby w czasie badań oraz w okresie miesiąca poprzedzającego badania nie wykazywały cech infekcji, nie przyjmowały leków mających wpływ na układ immunologiczny, nie miały też wykonywanej transfuzji krwi. Z badań zostały wykluczone osoby podające w wywiadzie choroby alergiczne.
Protokół badania został zaakceptowany przez Komisję Bioetyczną Uniwersytetu Medycznego w Lublinie. Pacjenci oraz ich rodzice wyrazili zgodę na badania i obserwacje.
U badanych dzieci oznaczano poziom 25(OH)D3 przy pomocy metody elektrochemiluminescencji w analizatorze Elecsys 2010, poziom c-peptydu metodą elektrochemiluminescencji dla pośredniej oceny funkcji jeszcze czynnych komórek beta wysp trzustki oraz miano przeciwciał przeciw dekarboksylazie kwasu glutaminowego (a-GAD) i przeciw fosfatazie tyrozyny (IA2) metodą ELISA firmy Immunotech, świadczących o podłożu autoimmunologicznym cukrzycy.
Wśród parametrów immunologicznych: odsetek niedojrzałych DC mieloidalnych BDCA-1+/CD19- oraz odsetek niedojrzałych DC plazmacytoidalnych BDCA-2+/CD123+ poddanych analizie w cytometrze przepływowym przy pomocy programu CellQuest.
Izolacja komórek mononuklearnych z krwi obwodowej
Krew obwodową rozcieńczono zbuforowanym roztworem soli fizjologicznej – PBS bez soli wapnia i magnezu (Biochrome AG, Niemcy) w proporcji 1:1. Rozcieńczoną krew nawarstwiono na preparat Gradisol L (Aqua Medica, Polska) o ciężarze właściwym 1,077 g/ml. Komórki wirowano w gradiencie gęstości przez 20 min. przy przyspieszeniu 700 xg. Uzyskane komórki płukano dwukrotnie w roztworze PBS bez Ca2+ i Mg2+. Następnie oceniono ich ilość w komorze Neubauera i żywotność za pomocą błękitu trypanu (0,4% Trypan Blue Soulution, Sigma, Niemcy). Żywotność poniżej 90% dyskwalifikowała komórki z dalszych badań.
Ocena krążących komórek dendrytycznych
Wyizolowane komórki mononuklearne wypłukano dwukrotnie w buforze PBS bez Ca2+ i Mg2+ z dodatkiem 0,5% albuminy bydlęcej (BSA) (Sigma-Aldrich, Niemcy) oraz 2mM EDTA (Sigma-Aldrich, Niemcy). Komórki zawieszano w wyżej opisanym buforze w ilości 80μl na 107 komórek oraz dodawano 20μl FcR Blocking Reagent (Miltenyi Biotec, Niemcy) w celu wykluczenia niespecyficznego wiązania przeciwciał przez fragment Fc. Następnie dodawano 10μl przeciwciał na 107 badanych komórek według następujących kombinacji: anty-BDCA-1 (CD1c) FITC (Miltenyi-Biotec, Niemcy)/anty-CD19 CyChrome (BD Pharmingen, USA) (Izotyp IgG1/IgG1), anty-BDCA-2 (CD303) FITC (Miltenyi-Biotec, Niemcy)/anty CD123 PE (Becton Dickinson, USA) (Izotyp IgG1/IgG1) i inkubowano przez 10 min. w tem. 4˚C w ciemności. Po upływie tego czasu dodawano 2 ml buforu i wirowano komórki przez 10 min. przy przyśpieszeniu 300 xg w tem. 4˚C. Po odwirowaniu i ostrożnym zlaniu supernatantu komórki podawano natychmiastowej analizie w cytometrze przepływowym. Przy pomocy programu CellQuest analizowano odsetek niedojrzałych komórek dendrytycznych mieloidalnych BDCA-1+/CD19- i plazmacytoidalnych BDCA-2+/CD123+ wśród mononuklearnych leukocytów.
Bankowanie komórek
Proces zamrażania przeprowadzony był w łaźni lodowej. Medium do zamrażania składało się z RPMI 1640 (Biochrome AG, Niemcy) z dodatkiem 10% ludzkiej albuminy (Baxter, USA) i 10% DMSO (ICN Polfa Rzeszów, Polska). Do 1 ml medium dodawano po 20 x 106 komórek. PBMC przechowywano w parach ciekłego azotu. Zamrożone komórki przenoszone były do łaźni wodnej o tem. 37ºC, gdzie stopniowo dodawana była pożywka RPMI 1640 z dodatkiem 10% ludzkiej albuminy. Następnie komórki odwirowano przy obrotach 700 xg przez 10 min., określono żywotność przy użyciu błękitu trypanu, zawieszono w odpowiednim buforze i przygotowano do oznaczanie odsetka limfocytów Treg. Jednocześnie przeprowadzano standardowe kliniczne monitorowanie przebiegu cukrzycy (badanie lekarskie, ocena glikemii, ketonemii, glikacji białek, dobowego zapotrzebowania na insulinę oraz monitorowanie równowagi wapniowo-fosforanowej).
Analiza statystyczna
Analizę statystyczną otrzymanych wyników przeprowadzono przy pomocy programu Statistica 7.0 PL. Zgodność rozkładu poszczególnych zmiennych w obrębie grup z rozkładem normalnym sprawdzono przy pomocy testu W Shapiro-Wilka.
Ponieważ badane zmienne nie miały rozkładu normalnego, do analizy użyto testów nieparametrycznych U Manna Whitneya do oceny różnic pomiędzy grupami. Otrzymane wyniki przedstawiono jako: medianę oraz wartość najmniejszą szeregu statystycznego (Min.) oraz wartość największą szeregu statystycznego (Maks.). Wyniki jako istotne statystycznie przyjmowano przy poziomie istotności p≤0.05.
Wyniki
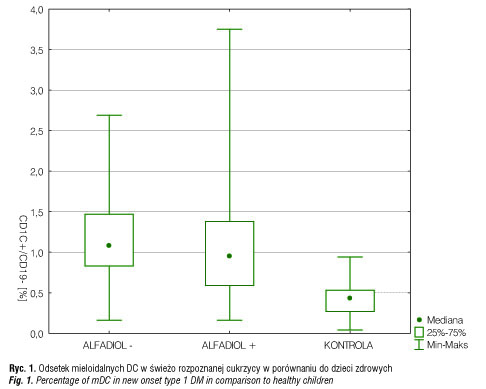
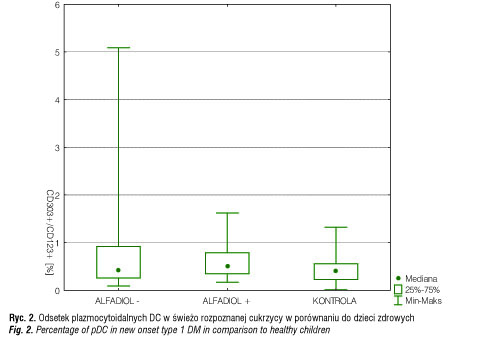
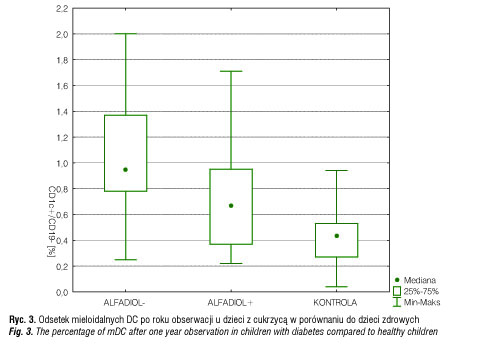
U 72% dzieci, które otrzymywały Alfadiol, oraz u 50% bez Alfadiolu stwierdzono wzrost lub utrzymywanie się wartości c-peptydu w ciągu rocznego monitorowania w porównaniu z wartościami wyjściowymi. W naszych badaniach przeanalizowaliśmy odsetek krążących we krwi dendrytycznych mieloidalnych BDCA-1+/CD19- i plazmacytoidalnych BDCA-2+/CD123+ wśród jednojądrzastych u pacjentów z nowo rozpoznaną cukrzycą typu 1 oraz po roku stosowania analogu witaminy D. Odsetek mieloidalnych DC w świeżo rozpoznanej cukrzycy wyniósł 0,99% i był istotnie statystycznie wyższy (p<0,05) w porównaniu do dzieci zdrowych (0,44%) (ryc. 1). Natomiast nie obserwowano różnic w odsetku komórek dendrytycznych plazmacytoidalnych w świeżo rozpoznanej cukrzycy w porównaniu do dzieci zdrowych (ryc. 2). Po roku obserwacji odsetek mieloidalnych DC u dzieci z cukrzycą nieotrzymujących Alfadiolu wyniósł 0,95% i różnił się zarówno w porównaniu do dzieci z cukrzycą otrzymujących Alfadiol (0,67%) (p<0,05), jak i w porównaniu do dzieci zdrowych (0,45%) (p<0,05) (ryc. 3). W grupie dzieci otrzymujących Alfadiol odsetek mieloidalnych DC po roku obserwacji nie różnił się istotnie statystycznie w porównaniu do dzieci zdrowych, natomiast odsetek DC w grupie dzieci nieotrzymujących Alfadiolu pozostał zbliżony do wartości wyjściowych. Nie stwierdzono istotnych różnic po roku obserwacji w odsetku komórek dendrytycznych plazmacytoidalnych.
Omówienie
W cukrzycy typu 1 komórki dendrytyczne odgrywają istotną rolę zarówno w inicjacji, jak i w podtrzymywaniu odpowiedzi immunologicznej przeciwko komórkom beta wysp trzustki. W ostatnich latach nieustannie poszukuje się czynnika o właściwościach immunomodulujących, który odpowiadałby za indukcję tolerancji immunologicznej przez komórki prezentujące antygen, jak komórki dendrytyczne i w następstwie hamowanie nadmiernej odpowiedzi immunologicznej skierowanej przeciw komórkom beta wysp trzustki, m.in. wskutek stymulacji komórek regulatorowych. Aktywna forma witaminy D (1,25(OH)2D3 jest uznanym czynnikiem o właściwościach hamowania odpowiedzi immunologicznej, m. in. przez wpływ na funkcję i fenotyp DC. W eksperymentalnych modelach zwierzęcych aktywna forma witaminy D lub zastosowane ligandy receptora dla witaminy D wpływały na hamowanie wydzielania IL12 przez komórki dendrytyczne, istotnej we wzbudzaniu odpowiedzi typu Th1, a poprzez zwiększenie produkcji IL10 na hamowanie dojrzewania i różnicowania DC zmniejszenie ekspresji cząsteczek kostymulujących CD80, CD86, CD40, prowadzące do zmniejszenia aktywacji limfocytów T [14–18]. We wcześniejszych badaniach własnych stwierdziliśmy obniżone stężenie witaminy D3 u większości dzieci z nowo rozpoznaną cukrzycą typu 1 [19]. Podobne wyniki otrzymali autorzy z ośrodka gdańskiego jak i z ośrodków zagranicznych [20,21]. Nie stwierdziliśmy natomiast korelacji poziomów witaminy D3 z odsetkiem badanych populacji komórek dendrytycznych. W grupie dzieci z nowo rozpoznaną cukrzycą typu 1 odnotowaliśmy istotnie wyższy odsetek krążących mieloidalnych komórek dendrytycznych. Steptoe i wsp. wykazali w modelu mysim wzrost generacji komórek dendrytycznych linii mieloidalnej [22], a Peng i wsp. stwierdzili blokadę dojrzewania komórek dendrytycznych w myszach NOD, co prowadziło do rozwoju zapalania wysp trzuskowoych [23]. Wyniki te pozostają w zgodności z naszymi, gdyż krążące mieloidalne komórki dendrytyczne BDCA-1+ wykazują cechy niedojrzałych komórek dendrytycznych [24]. Ciekawe, chociaż sprzeczne doniesienia opisują rolę plazmacytoidalnych DC w patogenezie cukrzycy typu 1. Chen i wsp. opisali istotnie obniżone odsetki pDC we krwi pacjentów w stosunku do zdrowych dawców [25]. Jednak w grupie Chen zdrowi dawcy byli istotnie starsi od pacjentów, podczas gdy w naszych badaniach nie było istotnych różnic wiekowych między badanymi grupami. Z kolei Allen i wsp. opisali istotnie wyższy odsetek plazmacytoidalnych komórek dendrytycznych we krwi osób z cukrzycą w porównaniu do zgodnej wiekowo grupy kontrolnej [26]. Vuckovic i wsp. oraz Nieminen i wsp. opisali jeszcze inne zależności, w ich badaniach pacjenci mieli istotnie obniżone odsetki obu populacji komórek dendrytycznych w porównaniu ze zgodną wiekowo grupą kontrolną [27,28]. Wyniki autorów fińskich mogą wskazywać ponadto na upośledzenie funkcji obu badanych populacji DC, stwierdzili oni bowiem zmniejszoną ekspresję CCR2- CC chemokine receptor 2, receptora dla monocyte chemoattractant protein-1 (CCL2) – chemokiny odgrywającej istotną rolę w chemotaksji DC do miejsc zapalnych.
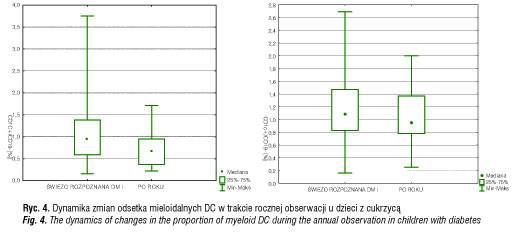
Po roku naszych obserwacji odsetek krążących komórek mieloidalnych istotnie obniżył się jedynie w grupie pacjentów otrzymujących analog witaminy D3 (Alfadiol) i jednocześnie nie różnił się istotnie w stosunku do grupy dzieci zdrowych. Ponadto, jak wykazaliśmy we wcześniejszych badaniach, w grupie otrzymującej Alfadiol dobowe zapotrzebowanie na insulinę było istotnie niższe, a poziom c-peptydu istotnie wyższy niż w grupie nieotrzymującej preparatu witaminy D [29,30]. Powyższe obserwacje mogą wskazywać na udział witaminy D
w zmniejszeniu nasilenia odpowiedzi autoimmunologicznej w cukrzycy typu 1 poprzez wpływ na komórki DC. Do potwierdzenia tej tezy niezbędne są dalsze badania eksperymentalne. Wykazano dotychczas, iż komórki dendrytyczne, które początkowo są odpowiedzialne za indukcję zjawisk autoimmunizacyjnych w patogenezie cukrzycy typu 1, mogą być użyteczne w immunomodulacji i indukcji autotolerancji [31]. W badaniach na myszach NOD wykazano, że modyfikowane komórki dendrytyczne mogą zapobiegać wystąpieniu cukrzycy [32], a także skutecznie ją leczyć [33]. W obu przypadkach za korzystny efekt odpowiadała indukcja limfocytów Treg przez komórki dendrytyczne.
Wnioski
1. Wyższy odsetek mieloidalnych DCs w grupie dzieci ze świeżo rozpoznaną cukrzycą w porównaniu do grupy kontrolnej może wskazywać na udział tych komórek w patogenezie cukrzycy typu 1 (promowanie odpowiedzi Th1).
2. Zmniejszenie się odsetka mDC w trakcie rocznego podawania Alfadiolu wskazuje na rolę witaminy D w mechanizmach „immunosupresyjnych” procesów autoimmunizacyjnych w cukrzycy typu 1.
3. Wykazane różnice dotyczące populacji komórek dendrytycznych wydają się wskazywać na pewne pozytywne elementy stosowanego analogu witaminy D3 u dzieci z cukrzycą typu 1.
Piśmiennictwo
1. Davies J.L., Kawaguchi Y., Bennett S.T. et al.; A genome-wide search for human type 1 diabetes susceptibility genes; Nature 1994:371, 130-136
2. Egwuagu C.E., Charukamnoetkanok P., Gery I.; Thymic expression of autoantigens correlates with resistance to autoimmune disease; J. Immunol. 159(1997), 3109-3112
3. Morel P.A., Vasquez A.C., Feili-Hariri M.; Immunobiology of DC in NOD mice; J. Leukoc. Biol. 1999:66, 276-280
4. Calderon B., Suri A., Miller M.J., Unanue E.R.; Dendritic cells in islets of Langerhans constitutively present beta cell-derived peptides bound to their class II MHC molecules; Proc Natl Acad Sci U S A 2008:105, 6121-6126
5. Brusko T.M., Putnam A.L., Bluestone J.A.; Human regulatory T cells: role in autoimmune disease and therapeutic opportunities; Immunol Rev. 2008:223, 371-390
6. Cantorna M.T., Mahon B.D.; D-hormone and immune system; J. Rheumatol. Suppl. 2005:76, 11-20
7. Harris S.; Can vitamin D supplementation in infancy prevent type 1 diabetes?; Nutrition Rev. 2002:60, 118-121
8. Mathieu C., Adorini L.; The coming of age of 1,25-dihydroxyvitamin D3 analogs as immunomodulatory agents; Trends Mol. Med. 2002:8, 174-179
9. Adorini L., Penna G., Giarratana N. et al.; Tolerogenic dendritic cells induced by vitamin D receptor ligands enhence regulatory T cells inhibiting allograft rejection and autoimmune diseases; Journal of Cellular Biochemistry 2003:88, 227-233
10. Mathieu C., van Etten E., Decallonne B. et al.; Vitamin D and 1,25-dihydroxyvitamin D(3) as modulators in the immune system; J. Steroid Biochem. Mol. Biol. 2004:89-90, 449-452
11. Mathieu C., Gyseman C., Giulietti A., Bonillon R.; Vitamin and diabetes; Diabetologia 2005:48, 1247-1257
12. Angelini F., Del Luca E., Piccinini S. et al.; Altered phenotype and function of dendritic cells in children with type 1 diabetes; Clin Exp Immunol. 2005:42, 341-346
13. Kadowaki N.; The divergence and interplay between pDC and mDC in humans; Front Biosci. 2009:14, 808-917
14. Berer A., Stockl J., Majdic O.; 1,25 – Dihydroxyvitamin D(3) inhibits dendritic cell differentiation and maturation in vitro; Exp. Hematol. 2000:28, 575-583
15. Canning M.O., Grotenhuis K., de Wit H. et al.; 1-alpha,25 Dihydroxyvitamin D3 (1,25(OH)(2)D(3)) hampers the maturation of fully active immature dendritic cells from monocytes; Eur. J. Endocrinol. 2001:145, 351-357
16. Griffin M.D., Lutz W.H., Phan V.A.; Dendritic cell modulation by 1,25-Dihydroxyvitamin D3 and its analogs: potent inhibition of dendritic cells differentiation and maturation by vitamin D analogs; Biochem. Biophys. Res. Commun. 2000:270, 701-708
17. Penna G., Adoroni L.; 1,25-Dihydroxyvitamin D3 inhibits differentiation, maturation, activation and survival of dendritic cells leading to impaired alloreactive T cell activation; J. Immunol. 2000:164, 2405-2411
18. Piemonti L., Monti P., Sironi M. et al.; Vitamin D3 affects differentiation, maturation and function of human monocytes-derived dendritic cells; J. Immunol. 2000:164, 4443-4451
19. Szewczyk L., Piekarski R., Azab Y., Wysocka-Łukasik B.; Poziom witaminy D3 w relacji do stopnia autoimmunizacji i dysfunkcji komórek beta w świeżo rozpoznanej cukrzycy typu 1; Endokrynol. Pediatr. 2008:7, 17-22
20. Myśliwiec M., Brandt A., Bautembach-Minkowska J. et al.; Ocena poziomu witaminy D3 u dzieci zdrowych i z nowo rozpoznaną cukrzycą typu 1; Endokrynol. Pediatr. 2008:7, 23-30
21. Pozzilli P., Manfrini S., Crino A. et al.; Low levels of 25-hydroxyvitamin D3 and 1,25-dihydroxyvitamin D3 in patients with newly diagnosed type 1 diabetes; Horm. Metab. Res. 2005:37, 680-683
22. Steptoe R.J., Ritchie J.M., Harrison L.C.; Increased generation of dendritic cells from myeloid progenitors in autoimmune-prone nonobese diabetic mice; J. Immunol. 2002:168, 5032-5041
23. Peng R., Bathjat K., Li Y. et al.; Defective maturation of myeloid dendritic cell (DC) in NOD mice is controlled by IDD10/17/18; Ann N Y Acad Sci. 2003:1005, 184-186
24. Dzionek A., Fuchs A., Schmidt P. et al.; BDCA-2, BDCA-3, and BDCA-4: three markers for distinct subsets of dendritic cells in human peripheral blood; J. Immunol. 2000:165, 6037-6046
25. Chen X., Makala L.H., Jin Y. et al.; Type 1 diabetes patients have significantly lower frequency of plasmacytoid dendritic cells in the peripheral blood; Clin Immunol. 2008:129, 413-418
26. Allen J.S., Pang K., Skowera A. et al.; Plasmacytoid dendritic cells are proportionally expanded at diagnosis of type 1 diabetes and enhance islet autoantigen presentation to T-cells through immune complex capture; Diabetes 2009:58, 138-145
27. Vuckovic S., Withers G., Harris M. et al.; Decreased blood dendritic cell counts in type 1 diabetic children; Clin Immunol. 2007:123, 281-288
28. Nieminen J.K., Vakkila J., Salo H.M. et al.; Altered phenotype of peripheral blood dendritic cells in pediatric type 1 diabetes; Diabetes Care. 2012:11, 2303-2310
29. Szewczyk L., Piekarski R.; Stopień autoimmunizacji i dysfunkcji komórek beta u dzieci z cukrzycą typu 1 po roku stosowania analogu vit. D; Endokrynol. Pediatr. 2010:9, 19-24
30. Szewczyk L., Bury A., Piekarski R.; Stosowanie profilaktycznej dawki Alfakalcidolu niezależnie od wieku dziecka podtrzymuje remisję u dzieci ze świeżo rozpoznaną cukrzycą typu 1. Dwuletnia obserwacja; Endokrynol. Ped. 2012:2, 17-22
31. Pasquali L., Giannoukakis N., Trucco M.; Induction of immune tolerance to facilitate beta cell regeneration in type 1 diabetes; Adv Drug Deliv Rev. 2008:60, 106-113
32. Cheatem D., Ganesh B.B., Gangi E. et al.; Modulation of dendritic cells using granulocyte-macrophage colony-stimulating factor (GM-CSF) delays type 1 diabetes by enhancing CD4+CD25+ regulatory T cell function; Clin Immunol. 2009:131:260-270
33. Tarbell K.V., Petit L., Zuo X. et al.; Dendritic cell-expanded, islet-specific CD4+ CD25+ CD62L+ regulatory T cells restore normoglycemia in diabetic NOD mice; J. Exp Med. 2007:204, 191-201








