Endokrynol. Ped. 11/2012;3(40):17-26
DOI: 10.18544/EP-01.11.03.1387
Analiza stężenia IL-17 i IL-23 w dynamice chorób autoimmunizacyjnych tarczycy u młodocianych
1Studenckie Koło Naukowe
2Klinika Pediatrii, Endokrynologii, Diabetologii z Pododdziałem Kardiologii. Uniwersytet Medyczny w Białymstoku. Polska
Słowa kluczowe: IL-17, IL-23, choroba Gravesa-Basedowa, zapalenie tarczycy typu Hashimoto
Streszczenie
W literaturze światowej coraz częściej podkreśla się ścisły związek między przebiegiem procesów zapalnych w obrębie tarczycy a zwiększonym uwalnianiem określonych cytokin, w tym IL-17, IL-23. Celem pracy była ocena stężenia IL-17 i IL-23 w surowicy pacjentów z chorobą Gravesa-Basedowa (GD), z zapaleniem tarczycy typu Hashimoto (HT) i w grupie kontrolnej dzieci zdrowych z ujemnym wywiadem w kierunku chorób zapalnych, układowych i nowotworowych. Badaniem objęto grupę 22 pacjentów z chorobą GD (średni wiek: 11,5±5,7 lat), 37 z zapaleniem Hashimoto (13,8±2,6 lat) i 21 zdrowych dzieci (14,3±2,2 lat), u których przeprowadzono analizę stężeń cytokin, przeciwciał przeciwtarczycowych i podstawowych parametrów hormonalnych istotnych w diagnostyce schorzeń gruczołu tarczowego. Pomiaru stężenia cytokin w surowicy krwi dokonano metodą ELISA z zastosowaniem czytnika ELx800 firmy Bio-Tek. U wszystkich pacjentów oznaczano przeciwciała antyperoksydazowe (anty-TPO), antytyreoglobulinowe (anty-TG) i anty-TSH receptorowi (TRAK) metodą elektrochemiluminescencji ECLIA za pomocą analizatora Modular Analytics E170 firmy Roche Diagnostics Polska. W obu grupach pacjentów ze schorzeniami autoimmunizacyjnymi wykazano istotne statystycznie podwyższenie stężenia IL-23 (GD:156,29±118,22 vs 69,04±38,23, p<0,004, HT:135,04±140,19 vs 69,04±38,23, p<0,046) w porównaniu do grupy kontrolnej. Zastosowanie leczenia tyreostatykiem w chorobie GD doprowadziło do obniżenia stężenia cytokiny w okresie 6–12 miesięcy, natomiast w przypadku trwającej 6–24 msc terapii L-tyroksyną w zapaleniu typu Hashimoto nie obserwowano obniżenia poziomu IL-23 w porównaniu z grupą kontrolną. Analiza stężenia IL-17 wykazała istotny wzrost jej wartości w przebiegu zapalenia tarczycy typu Hashimoto w porównaniu z grupą dzieci zdrowych (17,17±10,49 vs 11,381±2,9, p<0,021), jednakże w trakcie terapii poziom tej cytokiny uległ normalizacji. Przeprowadzona ocena zależności między stężeniami IL-17 i IL-23 a poziomami hormonów i przeciwciał przeciwtarczycowych w nieleczonym GD wykazała dodatnią korelację pomiędzy IL-23 a stężeniem przeciwciał anty-TPO (r=0,368, p<0,038) oraz TRAK (r=0,478, p<0,014). Podsumowując, można stwierdzić, że zarówno IL-17, jak i IL-23 indukując procesy zapalne odgrywają kluczową rolę w rozwoju schorzeń autoimmunizacyjnych tarczycy wieku rozwojowego
Wstęp
Choroby autoimmunizacyjne tarczycy: choroba Gravesa-Basedowa (GD) i przewlekłe limfocytarne zapalenie tarczycy typu Hashimoto (HT) spowodowane są przełamaniem tolerancji immunologicznej wobec własnych antygenów tarczycowych. Rozwija się proces zapalny wynikający z napływu limfocytów do gruczołu tarczowego oraz nasilonej produkcji przeciwciał skierowanych przeciwko receptorowi TSH, tyreoglobulinie i tyreoperoksydazie [1]. Dodatkowo aktywowane limfocyty T syntetyzują i uwalniają cytokiny będące ważnym mediatorem reakcji zapalnej. Wykazując działanie autokrynne, parakrynne i endokrynne cytokiny regulują wzrost i różnicowanie komórek aktywnych immunologicznie, jak też zaburzają procesy naturalnej śmierci komórek – apoptozy. Zwiększają ekspresję cząsteczek MHC I i II oraz molekuł adhezyjnych na komórkach pęcherzykowych tarczycy. Mają także zdolność stymulacji limfocytów T i B. Nasilają przez to produkcję przeciwciał i postępującą destrukcję tkanki gruczołu tarczowego [2].
Profil wydzielanych cytokin stał się podstawą do pierwotnej klasyfikacji limfocytów T pomocniczych CD4+ do dwóch zasadniczych grup: limfocytów Th1 produkujących głównie IL-2 i INF-γ oraz Th2 wydzielających m.in. IL-4, IL-5, IL-6, IL-10 i IL-13. Cytokiny obu populacji komórkowych ściśle korelują z pełnioną przez nie funkcją. Limfocyty Th1 zaangażowane są w odpowiedź komórkową, podczas gdy Th2 wspomagają odpowiedź humoralną. Dotychczasowe badania wskazywały, że zapalenie tarczycy typu Hashimoto, które charakteryzuje postępująca destrukcja tkanki tarczycowej i niedoczynność gruczołu, związane jest z przewagą działania limfocytów Th1, podczas gdy w chorobie Gravesa-Basedowa dominuje populacja Th2, prowadząc do nadmiernej stymulacji tarczycy przez autoprzeciwciała [3]. W ostatnich latach dzięki identyfikacji interleukiny 17 wyodrębniono odpowiedzialną za jej syntezę i wydzielanie nową, trzecią klasę limfocytów T pomocniczych – Th17. Różnicowanie naiwnych limfocytów T w kierunku populacji Th17 pierwotnie uważano za związane głównie z działaniem IL-23. Okazało się to jednak niemożliwe ze względu na brak ekspresji receptora tej interleukiny na ich powierzchni. Obecnie niezależne badania wykazują, że do różnicowania Th17 prowadzi współdziałanie IL-6 i TGF-β, a swoistym czynnikiem transkrypcyjnym tej linii komórek jest RORγt.
IL-23 działa natomiast na wyindukowane już Th17, posiadające na swojej powierzchni IL-23R, prowadząc do amplifikacji i stabilizacji tych komórek [4,5].
Odkrycie nowej populacji limfocytów Th17 doprowadziło do ponownego rozpatrzenia wcześniej istniejących teorii dotyczących patogenezy procesów autoimmunizacyjnych, a poznanie funkcji tych komórek ma szansę stać się dla tych teorii doskonałym uzupełnieniem. W świetle szczegółowych badań komórki Th17 posiadają silne działanie prozapalne, a IL-17 stymuluje szerokie spektrum komórek do produkcji cytokin (IL-6, IL-8, GM-CSF, G-CSF), chemokin i metaloproteinaz, a także odpowiada za rekrutację, aktywację i migracją neutrofili. W przypadku uczulenia na antygeny własne limfocyty Th17 mogą więc prowadzić do rozwoju silnej reakcji autoagresji. Teoria ta została już wielokrotnie potwierdzona w przypadku chorób takich, jak: reumatoidalne zapalenie stawów (RZS), łuszczyca, nieswoiste choroby zapalne jelit (IBD), w astmie i cukrzycy typu pierwszego, gdzie stężenie IL-17 oznaczane w surowicy pacjentów było wyraźnie podwyższone [6–10].
Cele niniejszej pracy to:
1. Ocena stężenia IL-17 i IL-23 w surowicy krwi u dzieci z nowo rozpoznaną chorobą Gravesa-Basedowa i zapaleniem tarczycy typu Hashimoto oraz w grupie kontrolnej.
2. Analiza stężenia tych cytokin w dynamice chorób autoimmunizacyjnych po zastosowaniu leczenia.
3. Określenie zależności pomiędzy stężeniem przeciwciał przeciwtarczycowych i hormonów tarczycy a stężeniem IL-17 i IL-23.
Materiały i metody
Badanie przeprowadzono w grupie pacjentów z chorobą Gravesa-Basedowa (n=22, średni wiek: 11,5±5,7 lat), z zapaleniem tarczycy typu Hashimoto (n=37, średni wiek: 13,8±2,6 lat), a także w grupie dzieci zdrowych (n=21, średni wiek: 14,3±2,2 lat) leczonych w Poradni Endokrynologicznej lub hospitalizowanych w Klinice Endokrynologii, Diabetologii z Pododdziałem Kardiologii Uniwersytetu Medycznego w Białymstoku. Spośród pacjentów z GD do badania włączono zarówno osoby nieleczone (n=11, średni wiek=11,4±5,9 lat), jak i przyjmujące metizol (n=11, średni wiek:11,5±5,6 lat). Lek podawano w okresie od 6 do 12 miesięcy w dawce początkowej 0,5–0,7 mg/kg m.c./dobę, która redukowana była w zależności od parametrów biochemicznych i klinicznych do 5 mg/dobę. Grupa pacjentów z HT także obejmowała dzieci niepoddane leczeniu (n=16, średni wiek:13,4±2,1) jak też leczone L-tyroksyną w dawce 50–25 µg/dobę przez okres 6–24 miesięcy od rozpoznania (n=21, średni wiek:14,3±2,2).
Grupę dzieci badanych z autoimmunizacyjnymi schorzeniami tarczycy porównano z grupą kontrolną 21 dzieci zdrowych z prawidłową czynnością gruczołu tarczowego, zgodną pod względem płci, wieku i masy ciała oraz z ujemnym wywiadem w kierunku chorób zapalnych, autoimmunologicznych i nowotworowych. Badania uzyskały zgodę lokalnej Komisji Bioetycznej UM w Białymstoku.
Krew do badań pobierano na czczo w godzinach rannych z żyły odłokciowej. Odwirowywano ją w wirówce przez 10 minut przy 2000 obrotów na minutę. Do chwili zebrania odpowiedniej ilości surowic do oznaczeń przechowywano je w temperaturze -85°C. W badanych surowicach oznaczano przeciwciała antyperoksydazowe (anty-TPO), antytyreoglobulinowe (anty-TG) i anty-TSH receptorowi (TRAK) za pomocą analizatora Modular Analytics E170 (moduł Elecsys) firmy Roche Diagnostics Polska, metodą elektrochemiluminescencji ECLIA. Wartości prawidłowe stężeń przeciwciał wynosiły odpowiednio: anty-TPO 0-34 IU/mL, czułość metody < 5,0 IU/ml; anty-TG 0-115 IU/mL, czułość metody < 10 IU/ml oraz anty-TSHR 0-1,75 IU/l, czułość metody 0,3 IU/l.
Z kolei oznaczenie stężeń wolnej tyroksyny (fT4), wolnej trójjodotyroniny (fT3) i TSH w surowicy krwi przeprowadzono za pomocą analizatora Cobas e 411 firmy Roche Diagnostics Polska metodą elektrochemiluminescencji ECLIA. Wartości prawidłowe hormonów wynosiły odpowiednio: fT4 – 0,9–1,8 ng/dl, czułość metody 0,023 ng/dl; fT3 – 2,0–5,2 pg/ml, czułość metody 0,26 pg/mL oraz TSH- 0,27–4,2 µIU/ml, czułość metody 0,005 µIU/mL.
Pomiaru stężenia IL-17 i IL-23 w surowicy krwi zestawem firmy R@D System dokonano metodą ELISA z zastosowaniem czytnika firmy Bio-Tek ELx800.
Analiza statystyczna
Uzyskane wyniki przedstawiono jako wartości średnie z odchyleniem standardowym (SD). Analizy statystycznej dokonano za pomocą programu Statistica 10 for Windows. Istotność różnic oceniono stosując testy nieparametryczne U Manna-Whitneya i ANOVA. Za istotne statystycznie uznano wartości, dla których współczynnik p był mniejszy od 0,05. Do oceny siły współzależności pomiędzy kolejnymi parametrami zastosowano współczynnik korelacji liniowej Pearsona.
Wyniki
W tabeli I przedstawiono wyniki pacjentów z chorobą Gravesa-Basedowa oraz grupy kontrolnej. W przypadku nieleczonych pacjentów wykazano istotne statystycznie obniżenie stężenia tyreotropiny (TSH: 0,05±0,07uIU/ml), natomiast podwyższenie stężenia trójjodotyroniny (fT3: 7,89±6,47pg/ml) i tyroksyny (fT4: 3,53±2,44ng/ml) w stosunku do dzieci zdrowych (TSH: 2,16±1,2 uIU/ml, fT3: 3,18±0,96pg/ml, fT4:1,06±0,29ng/ml) (p<0,001). W przypadku leczonych pacjentów poziomy hormonów ulegały normalizacji (TSH: 2,48±2,25uIU/ml, fT3: 3,64±0,99pg/ml, fT4: 1,21±0,20ng/ml) i nie różniły się istotnie od wyników grupy kontrolnej. Nieleczone dzieci z chorobą Gravesa-Basedowa wykazywały zwiększone stężenia wszystkich przeciwciał przeciwtarczycowych. Wartości te obniżały się w czasie leczenia metizolem, lecz nie ulegały całkowitej normalizacji, pozostając istotnie wyższe niż w grupie kontrolnej.
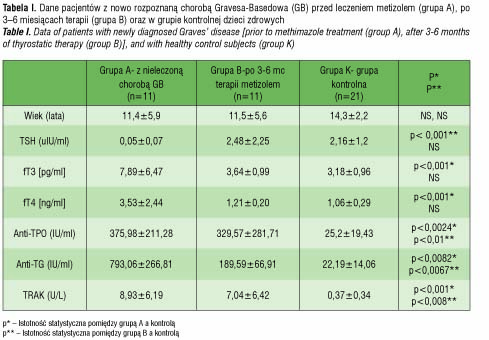
Tabela II prezentuje wyniki uzyskane w grupie pacjentów z HT i w grupie kontrolnej. Możemy zaobserwować charakterystyczne podwyższenie TSH wśród dzieci nieleczonych (22,99±7,40 uIU/ml, p<0,001) i normalizację stężenia hormonu pod wpływem leczenia L-tyroksyną (2,60±1,37uIU/ml, p=NS). Wartości stężeń przeciwciał anty-TPO i anty-TG były zwiększone w stosunku do grupy kontrolnej zarówno w przypadku pacjentów nieleczonych, jak i leczonych L-tyroksyną.
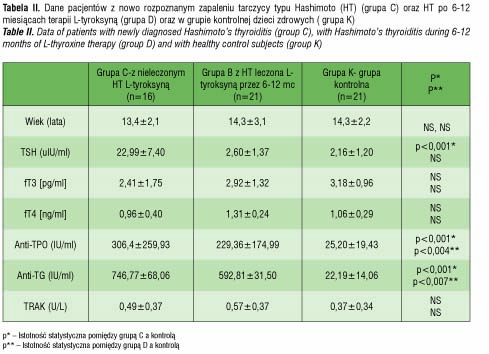
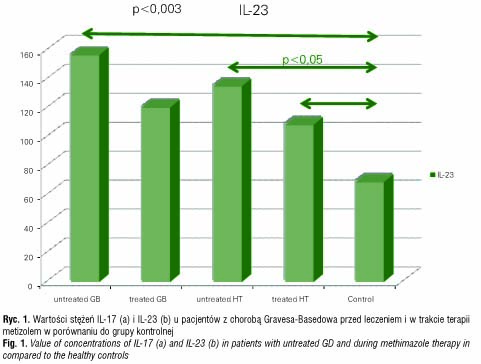
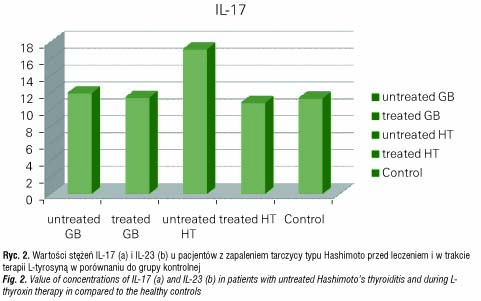
Analiza IL-17 i IL-23 w surowicy u pacjentów z chorobą Gravesa-Basedowa wykazywała istotny statystycznie wzrost stężenia IL-23 w przypadku pacjentów z nowo rozpoznaną chorobą GB przy braku zmian stężenia IL-17 w odniesieniu do grupy kontrolnej (IL-23: p<0,003, IL-17: NS) (ryc. 1 a, b). W przypadku pacjentów z zapaleniem tarczycy typu Hashimoto obserwowano znamienny wzrost stężenia IL-23 zarówno w grupie nieleczonej (p<0,05), jak i leczonej (p<0,04) L-tyroksyną. Natomiast oznaczenie stężenia IL-17 wykazało jej istotne statystycznie podwyższenie w surowicy pacjentów z nieleczonym HT (p<0,02) oraz brak takiej zależności w przypadku pacjentów poddanych leczeniu (p=NS) (ryc. 2 a, b) .
Kolejnym etapem badania była analiza zależności między stężeniem cytokin a poziomem hormonów i przeciwciał przeciwtarczycowych. W grupie nieleczonych pacjentów z GB wykazaliśmy pozytywną korelację między poziomem IL-23 a stężeniem przeciwciał TRAK (r=0,4779, p< 0,014) (ryc. 3) i anty-TPO (r=0,3681, p<0,038) (ryc. 4), natomiast dla IL-17 nie zaobserwowano takich zależności.
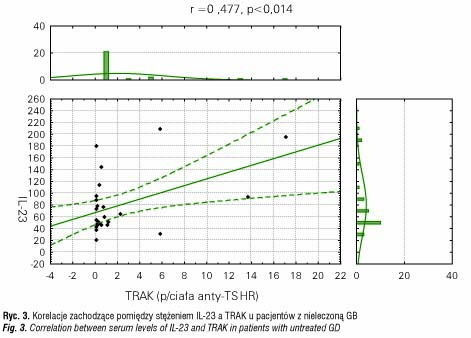
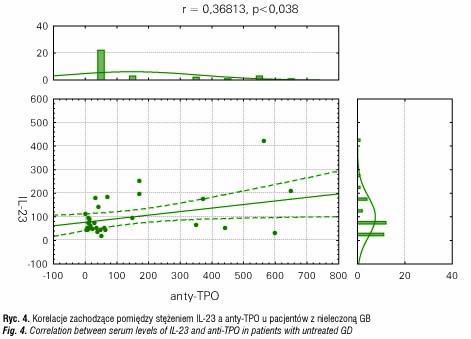
W grupie pacjentów z HT nie wykazano istotnych korelacji pomiędzy stężeniem hormonów tarczycy i przeciwciał przeciwtarczycowych a poziomem obu badanych cytokin.
Dyskusja
Nniewiele jest prac dotyczących wpływu IL-17 i IL-23 na rozwój chorób autoimmunizacyjnych tarczycy, a te, które powstały, nie dały jednoznacznych wyników. Brakuje także doniesień na ten temat w literaturze z zakresu endokrynologii dziecięcej. W jednej z nielicznych publikacji Zhou i wsp. oceniali wpływ limfocytów Th17 i limfocytów T regulatorowych (Treg) na rozwój GD na modelach mysich [11]. Wyniki wykazały istotne obniżenie liczby Tregs i podwyższenie stosunku Th17/Tregs, natomiast sama liczba komórek Th17 nie różniła się od wyników grupy kontrolnej. Na tej podstawie wnioskowano, iż populacja tych komórek nie może być zaangażowana w proces autoimmunologiczny. Całkowicie odmienne obserwacje prezentują Nanba i wsp., według których obwodowa liczba komórek Th17 była istotnie wyższa w przypadku pacjentów z AITD niż w grupie kontrolnej [12]. Dodatkowo w chorobie Gravesa-Basedowa liczba Th17 ulegała obniżeniu pod wpływem leczenia, wciąż pozostając jednak wyższą od wartości obserwowanych u osób zdrowych. Huber i wsp. wykazali w swojej pracy związek polimorfizmów genu IL-23R z predyspozycją do rozwoju choroby Gravesa-Basedowa i oftalmopatii tarczycowej [13]. Określone warianty tego genu prowadziły do nadmiernej ekspresji receptora dla IL-23 i nasilenia procesu różnicowania limfocytów T w kierunku populacji Th17, co prowadziło do zwiększonej syntezy IL-17 i do rozwoju choroby. Z kolei Figueroa-Vega i wsp. oceniali osoczowe stężenia IL-17, IL-22 i innych cytokin zaangażowanych w różnicowanie komórek w kierunku Th17 (m.in. IL-23) wśród pacjentów z GD, HT i w grupie kontrolnej [14]. Chorzy z HT wykazywali zwiększoną liczbę komórek Th17 i wzrost stężenia wydzielanych przez nie cytokin zarówno we krwi obwodowej, jak i w obrębie gruczołu tarczowego. Ponadto dokonana przez autorów analiza histochemiczna wykazała znaczący wzrost ekspresji receptora IL-23 na powierzchni limfocytów naciekających gruczoł tarczowy w HT, bez takiej tendencji w przypadku GD i grupie kontrolnej. Obecność IL-23 według tych obserwacji wywoływała in vitro w próbkach pacjentów z GD i HT nasilone różnicowanie komórek w kierunku Th17 w porównaniu do grupy kontrolnej.
W naszych badaniach u dzieci z nowo rozpoznaną HT otrzymaliśmy istotne statystycznie zwiększone stężenie IL-17 we krwi obwodowej, co może przemawiać za udziałem populacji Th17 w patogenezie choroby, oraz istotne podwyższenie stężenia IL-23 niezbędnej do stabilizacji i funkcjonowania tej linii limfocytów. Patogeneza zapalenia tarczycy typu Hashimoto oraz wielu innych znanych nam chorób autoimmunizacyjnych przez długi czas wiązana była z wydzielającą IFN-γ populacją komórek Th1. Obecnie trwają poszukiwania zależności między Th1 i Th17, jako że obie populacje komórek wydają się brać czynny udział w patogenezie procesów autoagresji. Rzeczywiście dowiedziono już, że limfocyty Th1 wykazują na swojej powierzchni umiarkowaną ekspresję receptora IL-17, która działając przez ten receptor hamuje ekspresję genów czynnika transkrypcyjnego limfocytów Th1 – T-bet, a także hamuje produkcję IFN-γ.
Prowadzi to do zniesienia funkcji Th1. Odwrotnie, przy nieobecności Th17 odpowiedź komórek Th1 ulega nasileniu [15].Takie zjawiska nie tłumaczą jednak całkowicie zwiększonego stężenia IL-17 i IL-23 w chorobach autoimmunizacyjnych. Wydaje się, że oprócz wzajemnej kontrregulacji limfocyty Th1 i Th17 mogą potrzebować siebie nawzajem, a cytokiny produkowane i wydzielane przez jedną linię komórkową zapoczątkowują proces zapalny, umożliwiając napływ kolejnej populacji komórek. Wykrycie w surowicy pacjentów z HT podwyższonego stężenia IL-17 i IL-23 nie zaprzecza więc dotychczasowym przekonaniom o udziale linii Th1 w patogenezie choroby, a może nawet przyczynić się do lepszego jej zrozumienia.
W przypadku pacjentów z GD nie wykazaliśmy istotnych statystycznie różnic w stężeniu IL-17 w porównaniu do grupy kontrolnej. Można tłumaczyć to mniejszym nasileniem procesu zapalnego, niż ma to miejsce w przebiegu choroby Hashimoto. GD charakteryzuje się wczesną manifestacją kliniczną, którą poprzedza minimalne zniszczenie gruczołu. Ponadto patogeneza choroby Gravesa-Basedowa uważana jest głównie za Th2-zależną. Dotychczasowe badania wskazują natomiast, że to limfocyty Th1 są głównymi efektorami odpowiedzi autoimmunologicznej, podczas gdy komórki Th2 antagonizują ich funkcję poprzez wydzielanie cytokin przeciwzapalnych i hamowanie funkcji makrofagów [16]. Istotnie, większość chorób rozpatrywanych pod kątem wpływu limfocytów Th17, w których obserwowano podwyższenie IL-17, wykazywała przewagę odpowiedzi limfocytów Th1 (np.: RZS, cukrzyca typu 1, łuszczyca, stwardnienie rozsiane). Nie pozwala to jednak na wykluczenie wpływu Th17 na rozwój choroby, jako że stężenie IL-23 u pacjentów z nieleczonym GD pozostaje podwyższone w stosunku do grupy kontrolnej. Jak można więc takie obserwacje wytłumaczyć? IL-23 prawdopodobnie potrzebna jest wcześniej w przebiegu procesu autoagresji, zaś IL-17 odgrywa rolę w późniejszych stadiach choroby. Wiadomo też, że IL-23 moduluje funkcje Th17 (upstream regulator) i umożliwia przetrwanie i proliferację tych komórek. Prawdopodobnie u badanych przez nas pacjentów proces autoagresji był w zbyt wczesnym stadium, aby wykazać podwyższone stężenie IL-17 wydzielanej przez pobudzane przez IL-23 limfocyty Th17. Z drugiej strony istnieją doniesienia, że funkcja IL-23 nie ogranicza się wyłącznie do podtrzymywania działania Th17. Może bezpośrednio aktywować makrofagi lub komórki dendrytyczne wykazujące ekspresję IL-23R i nasilać produkcję mediatorów zapalnych, takich jak TNF-α czy IL-1. Potwierdzeniem niezależności działania IL-23 było przeprowadzone eksperymentalne zapalenie naczyniówki. W badaniu tym IL-23 okazała się niezbędna w rozwoju choroby, podczas gdy odpowiedź limfocytów Th17 mogła być zastąpiona odpowiedzią Th1 [17]. Właśnie tę niezależną aktywność IL-23 mogą odzwierciedlać otrzymane przez nas wyniki.
Oznaczając stężenia IL-17 i IL-23 zarówno u dzieci z nieleczonym GD, jak też u pacjentów przyjmujących tyreostatyki mieliśmy na celu ocenę wpływu zastosowanego leczenia na uzyskane wyniki. Zaobserwowaliśmy, że przyjmowanie znanego ze swoich właściwości immunosupresyjnych metizolu prowadzi do normalizacji stężenia IL-23. Uzyskane pod wpływem zastosowanej terapii obniżenie poziomu hormonów tarczycowych do stanu eutyreozy prowadzi bowiem do zmniejszenia nasilenia toczącego się w obrębie gruczołu procesu zapalnego, a przez to do zmniejszenia wydzielania cytokin prozapalnych. W przypadku chorych z HT po zastosowaniu terapii substytucyjnej L-tyroksyną poza oczekiwanym efektem w postaci normalizacji poziomu TSH dochodziło do istotnego obniżenia stężenia IL-17. Pod wpływem leczenia zmniejszeniu ulegało również stężenie IL-23, utrzymując się jednak na istotnie wyższym poziomie niż w grupie kontrolnej. Brak całkowitej normalizacji poziomu tej interleukiny może być wynikiem większego nasilenia procesu zapalnego w przebiegu HT niż w przypadku GD. Manifestacja kliniczna niedoczynności zwykle występuje późno i poprzedzona jest zniszczeniem znacznej części gruczołu. W surowicy badanych przez nas pacjentów w trakcie leczenia obserwowaliśmy utrzymujące się na istotnie wyższym poziomie niż w grupie kontrolnej stężenia przeciwciał przeciwtarczycowych, co może wskazywać na toczący się nadal proces autodestrukcji i związane z tym wytwarzanie cytokiny o działaniu prozapalnym. Tendencja w kierunku obniżania się stężenia IL-23 w połączeniu z istotnym spadkiem stężenia IL-17 sugeruje jednak osłabienie odpowiedzi limfocytów Th17. Możliwe więc, że normalizacja IL-23 jest jedynie kwestią wydłużenia czasu leczenia L-tyroksyną.
W niniejszej pracy zajęliśmy się także wykazaniem zależności między stężeniem IL-17 i IL-23 a poziomem hormonów i przeciwciał przeciwtarczycowych. Powszechnie wiadomo, iż w GD nasilenie procesu zapalnego, progresja choroby oraz częstość nawrotów po leczeniu najlepiej korelują ze stężeniem przeciwciał wiążących się z receptorem TSH (TRAK). Obniżenie stężenia tych przeciwciał w surowicy podczas terapii metizolem lub ich niskie wyjściowe stężenie stanowią pozytywną prognozę choroby, podczas gdy pacjenci wykazujący dużą wartość krążących TRAK rokują co do leczenia znacznie gorzej. Takie obserwacje znalazły potwierdzenie w otrzymanych przez nas wynikach. Wykazaliśmy w GD istotną korelację stężenia IL-23 ze stężeniem TRAK i słabszą, ale również istotną statystycznie, z anty-TPO. Oznacza to, że zmiany poziomu przeciwciał znajdują swoje odzwierciedlenie w zmianach stężenia IL-23, a do momentu kiedy są podwyższone, w obrębie gruczołu toczy się proces zapalny. IL-23 wytwarzana jest przez komórki prezentujące antygen (APC) i sama je zwrotnie pobudza. Dochodzi do prezentacji autoantygenów tarczycowych i aktywacji limfocytów T, które przez stymulację limfocytów B prowadzą do dalszej produkcji przeciwciał i ciągłego postępu choroby. Włączenie leczenia metizolem hamuje proces zapalny i doprowadza do normalizacji stężenia wydzielanych prozapalnych cytokin. Taką immunomodulującą rolę metizolu wykazał Weetmana i wsp. w związku z jego udziałem w stabilizacji śródbłonka naczyń oraz błon komórkowych tyreocytów w odniesieniu do uwalniania przez nie cytokin, a tym samym normalizacji zaburzeń dystrybucji limfocytów CD4/CD8 [18] .
Podsumowując, należy stwierdzić, iż udział IL-17 i IL-23 w rozwoju chorób autoimmunizacyjnych tarczycy może być początkiem nowego podejścia do patogenezy AITD i ich leczenia. Przeciwciała monoklonalne skierowane przeciwko IL-17 (secukinumab) znalazły zastosowanie m.in. w leczeniu łuszczycy i od marca 2012 r. są w trzeciej fazie badań klinicznych. Z kolei przeciwciało przeciwko podjednostce p40 IL-23 (ustekimumab) zostało już dopuszczone do obrotu w leczeniu tej choroby. Trwają też badania nad wykorzystaniem leczenia skierowanego przeciwko tym cytokinom w schorzeniach takich, jak RZS czy chorobie Crohna [19]. W przyszłości prawdopodobnie będzie to możliwe również w przypadku HT i GD. Wymaga to jednak dalszych obserwacji.
Wnioski
1. Zmiany stężenia IL-17 jak i IL-23 we krwi obwodowej u pacjentów z AITD wskazują, iż pełnią one kluczową rolę zarówno w indukcji procesów zapalnych, jak i przebiegu procesu immunologicznego w schorzeniach tarczycy wieku rozwojowego.
2. Istotne statystycznie korelacje zachodzące między stężeniem IL-23 a poziomem przeciwciał TRAK i anty-TPO świadczą o związku działania tej cytokiny z produkcją przeciwciał przeciwtarczycowych.
3. Zastosowanie leczenia w autoimmunizacyjnych chorobach tarczycy doprowadza w chorobie GB do normalizacji stężenia cytokin, podczas gdy u pacjentów z HT prowadzi jedynie do obniżenia poziomu IL-17 przy nadal nieco podwyższonym stężeniu IL-23.
Piśmiennictwo
1. Kawashima A., Tanigawa K., Akama T. et al.; Innate immune activation and thyroid autoimmunity; J. Clin. Endocrinol. Metab. 2011:96 (12), 3661-3671
2. Bossowski A., Harasymczuk J., Moniuszko A. et al.; Cytometric evaluation of intracellular IFN-γ and IL-4 levels in thyroid follicular cells from patients with autoimmune thyroid diseases; Thyroid Res. 2011:23 (4), 13
3. Phenekos C., Vryonidou A., Gritzapis A.D. et al.; Th1 and Th2 Serum Cytokine Profiles Characterize Patients with Hashimoto’s Thyroiditis (Th1) and Graves’ Disease (Th2); Neuroimmunomodulation 2004:11, 209-213
4. Dardalhon V., Korn T., Kuchroo V.K., Anderson A.C.; Role of Th1 and Th17 cells in organ-specific autoimmunity; J. Autoimmun. 2008 November:31(3), 252-256
5. Damsker J.M., Hansen A.M., Caspi R.R.; Th1 and Th17 cells: Adversaries and collaborators; Ann N Y Acad Sci. 2010 January:1183, 211-221
6. Nistala K., Moncrieffe H., Newton K.R. et al.; Interleukin-17-producingTcells are enriched in the joints of children with arthritis, but have a reciprocal relationship to regulatory T cell numbers; Arthritis Rheum. 2008:58, 875-887
7. Kryczek I., Bruce A.T., Gudjonsson J.E. et al.; Induction of IL-17 T cell trafficking and development by IFNgamma: mechanism and pathological relevance in psoriasis; J. Immunol. 2008:181, 4733-4741
8. Hundorfean G., Neurath M.F., Mudter J.; Functional Relevance of T Helper 17 (Th17) Cells and the IL-17 Cytokine Family in Inflammatory Bowel Disease; Inflamm. Bowel Dis. 2012:18, 180-186
9. Traves S.L., Donnelly L.E.; Th17 cells in airway diseases; Curr. Mol. Med. 2008:8, 416-426
10. Mensah-Brown E.P., Shahin A., Al-Shamsi M., Lukic M.L.; New member of the interleukin-12 family of cytokines: IL-23 and IL-27 modulate autoimmune diabetes; Ann. N.Y. Acad. Sci. 2006 Oct:1079, 157-160
11. Zhou J., Bi M., Fan C. et al.; Regulatory T cells but not T helper 17 cells are modulated in an animal model of Graves’ hyperthyroidism; Clin. Exp. Med. 2012 Mar:12(1), 39-46
12. Nanba T., Watanabe M., Inoue N., Iwatani Y.; Increases of the Th1/Th2 cell ratio in severe Hashimoto’s disease and in the proportion of Th17 cells in intractable Graves’ disease; Thyroid 2009 May:19(5), 495-501
13. Huber A.K., Jacobson E.M., Jazdzewski K. et al.; Interleukin (IL)-23 Receptor Is a Major Susceptibility Gene for Graves’ Ophthalmopathy: The IL-23/T-helper 17 Axis Extends to Thyroid Autoimmunity; J. Clin. Endocrinol. Metab. 2008 March:93(3), 1077-1081
14. Figueroa-Vega N., Alfonso-Pérez M., Benedicto I. et al.; Increased Circulating Pro-Inflammatory Cytokines and Th17 Lymphocytes in Hashimoto’s Thyroiditis; J. Clin. Endocrinol. Metab. 2010 Feb:95(2), 953-962
15. Awasthi A., Kuchroo V.K.; IL-17A directly inhibits TH1 cells and thereby suppresses development of intestinal inflammation; Nat Immunol. 2009 Jun:10(6), 568-570
16. Nicholson L.B., Kuchroo V.K.; Manipulation of the Thl/Th2 balance in autoimmune disease; Curr. Opin. Immunol. 1996 Dec:8(6), 837-842
17. Luger D., Silver P.B., Tang J. et al.; Either a Th17 or a Th1 effector response can drive autoimmunity: conditions of disease induction affect dominant effector category; J. Exp. Med. 2008 Apr 14:205(4), 799-810
18. Weetman A.P., Tandon N., Morgan B.P.; Antithyroid drugs and release of inflammatory mediators by complement-attracted thyroid cells; Lancet 1992:340, 633
19. Toussirot E.; The IL23/Th17 pathway as a therapeutic target in chronic inflammatory diseases; Inflamm. Allergy Drug Targets 2012:11(2), 159-168








