Endokrynol. Ped. 11/2012;2(39):65-70
DOI: 10.18544/EP-01.11.02.1384
Wrodzona niedoczynność tarczycy u noworodka matki z chorobą autoimmunizacyjną tarczycy
1Klinika Endokrynologii Dzieci i Młodzieży Katedry Pediatrii, Polsko-Amerykański Instytut Pediatrii, Collegium Medicum, Uniwersytet Jagielloński, Kraków
2Pracownia Badań Przesiewowych i Błędów Metabolicznych, Uniwersytecki Szpital Dziecięcy, Kraków
Słowa kluczowe: wrodzona niedoczynność tarczycy, choroba autoimmunizacyjna tarczycy w ciąży
Streszczenie
Wrodzona niedoczynność tarczycy (WNT) indukowana przeciwciałami przeciwko receptorowi TSH (TRAb) o charakterze blokującym odpowiada za około 2% wszystkich przypadków WNT. Przedstawiamy przypadek noworodka płci żeńskiej z ciąży I, porodu I, urodzonego cięciem cesarskim w 40 tygodniu ciąży, z masą ciała 3150 g, długością 54 cm, skalą Apgar odpowiednio 8 oraz 10 punktów po 1 i 5 minucie. W wywiadzie u matki wystąpiła nadczynność tarczycy leczona tyreostatykami przez 5 lat, a następnie niedoczynność tarczycy suplementowana L-tyroksyną przez 3 lata przed zajściem w ciążę oraz w trakcie jej trwania. Według dostępnych danych suplementacja L-tyroksyną w okresie ciąży była niewystarczająca, okresowo występowała hipotyroksynemia. W badaniu przesiewowym u noworodka w kierunku WNT stężenie TSH w kropli krwi na bibule wynosiło 130,5 mIU/L (N<15). Oznaczone w 4 dobie życia w surowicy krwi stężenie TSH>60 mIU/L (N:0,4-9) oraz fT4 9,6 pmol/l (N:10-26) potwierdziło rozpoznanie WNT. Wysokie stężenie TRAb u dziecka (67,8 IU/L, N<1) korelowało ze stężeniem TRAb u matki (68,5 IU/L). W badaniu ultrasonograficznym stwierdzono tarczycę o prawidłowym położeniu i wielkości przy równoczesnym braku wychwytu znacznika przez gruczoł tarczowy w badaniu scyntygraficznym z użyciem Tc99m. W 7 dobie życia włączono suplementację L-tyroksyną w dawce 12 μg/kg/d, modyfikowaną na podstawie oznaczeń fT4 i TSH w surowicy. Obserwowano zmniejszające się zapotrzebowanie na L-tyroksynę oraz normalizację stężenia TRAb, które w 4 miesiącu życia dziecka wynosiło 0,7 IU/L. Po ukończeniu przez dziewczynkę 2 roku życia podjęto decyzję o wykonaniu weryfikacji rozpoznania WNT, która pozwoliła na rozpoznanie przejściowej postaci schorzenia. Przedstawiony przypadek potwierdza znaczenie diagnostyczne oznaczania TRAb u noworodków z WNT matek z chorobą autoimmunologiczną tarczycy
Wstęp
Wrodzona pierwotna niedoczynność tarczycy (WNT) jest schorzeniem występującym z częstością 1:3000 – 1:4000 noworodków [1,2]. Wczesne postawienie rozpoznania WNT oraz, niezależnie od trwałego lub przejściowego charakteru schorzenia, wdrożenie suplementacji L-tyroksyną zapobiega poważnym skutkom niedoboru hormonów tarczycy w postaci upośledzenia rozwoju somatycznego i umysłowego [3].
Większość przypadków WNT ma charakter trwały i jest wynikiem zaburzeń rozwoju tarczycy lub syntezy hormonów tarczycy [4,5]. Według dostępnych w piśmiennictwie danych niedoczynność tarczycy o charakterze przejściowym dotyczy około 10–30% dzieci wyłonionych w badaniu przesiewowym w kierunku WNT i spowodowana może być niedoborem jodu, wcześniactwem, nadmiarem jodu (stosowanie leków/środków antyseptycznych zawierających jod, jodowych środków kontrastujących) lub autoimmunizacyjną chorobą tarczycy u matki [2,6,7]. Zgodnie z badaniami populacyjnymi Browna i wsp. oraz Mengreli i wsp. w około 2–2,7% WNT spowodowana jest przeciwciałami blokującymi receptor TSH pochodzenia matczynego, które przechodząc do płodu w odpowiednio wysokim mianie mogą hamować czynność tarczycy [8,12]. Wobec znanej częstości WNT związanej z chorobą autoimmunizacyjną u matki we wszystkich przypadkach wrodzonych postaci niedoczynności tarczycy należy brać pod uwagę WNT wywołaną przeciwciałami blokującymi receptor TSH oraz dokonać weryfikacji rozpoznania, najwcześniej po ukończeniu przez dziecko drugiego, a optymalnie trzeciego roku życia [5,6].
Opis przypadku
Przedstawiamy przypadek noworodka płci żeńskiej z ciąży I, porodu I, urodzonego cięciem cesarskim w 40 tygodniu ciąży, z masą ciała 3150 g, długością ciała 54 cm, oceną w skali Apgar na odpowiednio 8 oraz 10 punktów po 1 i 5 minucie, u którego występowała przedłużająca się do 14 doby życia żółtaczka fizjologiczna.
Pomiędzy 17 a 23 rokiem życia matka leczona była tiamazolem z powodu nadczynności tarczycy, a następnie od 26 roku życia (3 lata przed zajściem w ciążę oraz w trakcie jej trwania) otrzymywała suplementację L-tyroksyną z powodu niedoczynności tarczycy. Przebieg kliniczny choroby wskazywał na autoimmunizacyjną chorobę tarczycy u matki, etiologia schorzenia nie była jednak udokumentowana
oznaczeniem przeciwciał i/lub badaniem ultrasonograficznym tarczycy. Według dostępnych danych suplementacja L-tyroksyną w okresie ciąży była niewystarczająca, w 2 trymestrze ciąży udokumentowano hipotyroksynemię (fT4–0,72 ng/dL, n:0,8–1,9), a w 3 trymestrze hipertyreotropinemię (TSH–13,3 mIU/L, n: 0,4–4,0), profilaktyka jodowa została wdrożona dopiero w 3 trymestrze ciąży.
Po urodzeniu w badaniu przesiewowym w kierunku WNT u noworodka stężenie TSH w kropli krwi na bibule wynosiło 130,5 mIU/L. Podwyższone stężenie TSH (> 60 mIU/L) wraz z obniżonym stężeniem fT4 (9,6 pmol/L) oznaczone w surowicy krwi w 4 dobie życia potwierdziło rozpoznanie WNT. W badaniu fizykalnym poza zażółconą skórą, dużym przednim i obecnym tylnym ciemiączkiem nie stwierdzono nieprawidłowości.
W badaniu ultrasonograficznym stwierdzono tarczycę o prawidłowym położeniu, wielkości i nieznacznie obniżonej echogeniczności, która nie uwidoczniła się w badaniu scyntygraficznym z użyciem Tc99m. Nie uwidoczniono również ognisk ekotopowego wychwytu znacznika. Na obecność tarczycy wskazywało także prawidłowe stężenie tyreoglobuliny w surowicy (10,9 ng/mL, n: 2–70).
W 7 dobie życia włączono suplementację L-tyroksyną w dawce 12 μg/kg/d i kontynuowaną ją do 26 miesiąca życia w modyfikowanych, na podstawie oznaczeń fT4 i TSH w surowicy, dawkach. Wywiad dotyczący choroby tarczycy u matki wraz z brakiem wychwytu radioizotopu przez tarczycę sugerowały możliwość przejściowej WNT związanej z obecnością przeciwciał blokujących receptor TSH. Wysokie, całkowite stężenie w surowicy przeciwciał mających powinowactwo do receptora TSH (TRAb) u dziecka wynosiło 67,8 IU/L (N<1) i korelowało ze stężeniem TRAb u matki – 68,5 IU/L. W kolejnych miesiącach u dziecka obserwowano normalizację stężenia TRAb, którego miano w 4 miesiącu
życia było ujemne i wynosiło 0,7 IU/L (tab. I).
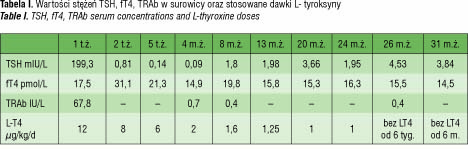
Obserwowano zmniejszające się zapotrzebowanie na L-tyroksynę, które w drugim roku leczenia wynosiło około 1 µg/kg/d, stężenia fT4 w surowicy w trakcie suplementacji L-tyroksyną pozostawały prawidłowe, okresowo obserwowano jednak supresję TSH (tab. I). W związku z potwierdzoną obecnością TRAb w surowicy dziecka korelującą ze stężeniem TRAb u matki wraz z obniżaniem się stężenia tych przeciwciał aż do wartości prawidłowych oraz zmniejszającym się zapotrzebowaniem na L-tyroksynę, podjęto decyzję o wykonaniu weryfikacji rozpoznania WNT po ukończeniu przez dziewczynkę 2 roku życia.
Prawidłowe stężenie fT4 i TSH w surowicy oraz obecność wychwytu technetu przez tarczycę w badaniu scyntygraficznym po 6 tygodniach od odstawienia L-tyroksyny, pozwoliły, zgodnie z danymi klinicznymi, na rozpoznanie przejściowej postaci WNT powodowanej przeciwciałami blokującymi receptor TSH i podjęcie decyzji o zaprzestaniu stosowania L-tyroksyny. Aktualnie 2,5-letnia dziewczynka pozostaje w klinicznej i biochemicznej eutyreozie, rozwój somatyczny i intelektualny dziewczynki jest prawidłowy.
Metody
Stężenie TSH w kropli krwi na bibule: LIA, Dia Sorin, Włochy; wartości referencyjne: 3–6 d.ż. < 15 mIU/L.
Stężenie TSH i fT4 w surowicy: RIA, Brahms Diagnostica GmbH, Berlin, Niemcy; wartości referencyjne: TSH: 2 t.ż. – 2 r.ż.: 0.8-9.1 mIU/L, >2 r.ż.: 0.3–4.0 mIU/L; fT4: 10–25 pmol/L.
Stężenie tyreoglobuliny w surowicy: Tg-pluS RIA, Brahms GmbH, Berlin, Niemcy; wartości referencyjne: 2–70 ng/Ml.
Stężenie TRAb w surowicy: RRA, TRAK-human, Brahms Diagnostica GmbH, Berlin, Niemcy; wartości referencyjne <1 IU/L wynik ujemny, 1–1,5 IU/L wynik graniczny, >1,5 wynik dodatni.
Badanie ultrasonograficzne tarczycy: LOGIQ 7 (Jokohama Medical System, Japonia), głowica liniowa 7,5 MHz.
Badanie scyntygraficzne tarczycy: gammakamera (General Electric Medical System, Starcam Milwaukee, WI, USA); Tc99m i.v., dawka standardowa (< 3 m.ż. 0,2 mCi; 2–4 lata 0,5–0,75 mCi).
Dyskusja
Dzięki badaniu przesiewowemu w kierunku WNT, które w Polsce od 1994 r. obejmuje wszystkie żywo urodzone noworodki, możliwe jest rozpoznanie wrodzonej niedoczynności tarczycy we wczesnym okresie noworodkowym i wdrożenie suplementacji L-tyroksyną do 14 doby życia. Zapobiega to wystąpieniu objawów niedoboru hormonów tarczycy, w tym najpoważniejszego z nich – trwałego upośledzenia umysłowego.
W dostępnym piśmiennictwie istnieją opisy przypadków noworodków z rodzinną przejściową WNT, w których choroba autoimmunizacyjna tarczycy matki charakteryzuje się początkowo nadczynnością, a następnie niedoczynnością tarczycy [9]. Ten zmienny obraz kliniczny pojawiający się u tego samego pacjenta w różnym okresie wynika z istniejącej w danym momencie przewagi przeciwciał stymulujących lub blokujących receptor TSH. Najczęściej jednak rodzinna przejściowa WNT dotyczy dzieci matek z autoimmunizacyjnym zapaleniem tarczycy rozpoznanym przed lub w czasie ciąży [10,11]. Do wystąpienia jawnej lub subklinicznej niedoczynności tarczycy u noworodka dochodzi wówczas w mechanizmie przechodzenia przez łożysko przeciwciał blokujących receptor TSH. Inne przeciwciała występujące w chorobach autoimmunizacyjnych tarczycy, takie jak np. przeciwciała przeciwko tyreoperoksydazie i tyreoglobulinie, także przechodzą przez łożysko, nie mają jednak znaczenia etiologicznego dla wystąpienia WNT u noworodka [niepublikowane badania własne, 12,13]. Matka opisywanego noworodka w przeszłości leczona była z powodu nadczynności tarczycy, z kolei wywiad dotyczący kilku lat przed zajściem w ciążę wskazywał na niedoczynność tarczycy wymagającą suplementacji L-tyroksyną. Wysokie miano przeciwciał przeciwko receptorowi TSH u noworodka korelowało ze stężeniem przeciwciał u matki. Zestawy komercyjne dla oznaczania stężenia przeciwciał przeciwko receptorowi TSH, stosowane także w naszym laboratorium, nie pozwalają na określenie ich charakteru (stymulujące vs blokujące). Na blokujący charakter tych przeciwciał wskazuje jednak obraz kliniczny wraz z wynikami badań hormonalnych i obrazowych [12,14].
Istotnym czynnikiem wpływającym na rozwój OUN u płodu/noworodka jest stan czynnościowy tarczycy matki w okresie ciąży. Hipotyroksynemia u matki w pierwszym trymestrze ciąży ma negatywny wpływ na rozwój OUN u zarodka, ponieważ tarczyca zarodka zaczyna produkować hormony tarczycy dopiero w 10–12 tygodniu życia [15]. W kolejnych trymestrach ciąży niedobór tyroksyny u matki jest kompensowany przez tyroksynę płodu. Niedobór hormonów tarczycy u matki ma natomiast istotne znaczenie w 2. i 3. trymestrze ciąży w przypadku niedoczynności tarczycy u płodu. U matki opisywanej pacjentki suplementacja L-tyroksyną przez cały okres ciąży mogła być niewystarczająca. W 20 miesiącu życia dziecka, w celu oceny wpływu płodowo-matczynej hipotyroksynemii na rozwój OUN, wykonano badanie przy użyciu skali Termana-Merrill, które wykazało przeciętny rozwój funkcji poznawczych (II=113) u dziewczynki.
Rozróżnienie postaci przejściowej i trwałej WNT w okresie noworodkowym może być w niektórych przypadkach utrudnione. Na rozpoznanie przejściowej niedoczynności tarczycy indukowanej przeciwciałami blokującymi receptor TSH wskazuje dodatnie miano tych przeciwciał jednocześnie u dziecka i u matki oraz zmniejszające się zapotrzebowanie na L-tyroksynę w trakcie jej stosowania (często manifestujące się, jak w opisywanym przypadku, supresją TSH). Obecność przeciwciał blokujących receptor TSH może również prowadzić do braku wychwytu znacznika izotopowego w badaniu scyntygraficznym; równocześnie jednak w badaniu ultrasonograficznym gruczoł tarczowy ma prawidłową morfologię i lokalizację. U pacjentki zostały spełnione wszystkie wymienione powyżej kryteria umożliwiające rozpoznanie WNT wywołanej przeciwciałami blokującymi receptor TSH.
W piśmiennictwie światowym istnieją doniesienia sugerujące u chorych z WNT spowodowaną przeciwciałami blokującymi receptor TSH pochodzącymi od matki, kontynuowanie suplementacji L-tyroksyną jedynie do momentu utrzymywania się tych przeciwciał w krążeniu dziecka, a więc przez okres 3 do 6 miesięcy [12,16]. U przedstawionej pacjentki, zgodnie z rekomendacjami Europejskiego Towarzystwa Endokrynologii Dziecięcej, weryfikację rozpoznania wrodzonej niedoczynności tarczycy wykonano po ukończeniu drugiego roku życia [3,5].
W podsumowaniu należy podkreślić, iż ustalenie etiologii WNT nie zawsze jest możliwe w okresie noworodkowym. Dla profilaktyki i wczesnego leczenia niedoczynności tarczycy u płodu/noworodka indukowanej przezłożyskowym transferem przeciwciał przeciwko receptorowi TSH optymalne byłoby monitorowanie stężenia TRAb w surowicy u matki z chorobą autoimmunizacyjną tarczycy przed planowaną ciążą oraz w okresie ciąży. Badanie takie, aczkolwiek zalecane przez niektórych autorów [17,18], najczęściej nie jest wykonywane w praktyce, stąd słuszne wydaje się rutynowe oznaczanie stężenia przeciwciał przeciwko receptorowi TSH u każdego noworodka z podejrzeniem wrodzonej postaci niedoczynności tarczycy. Należy mieć jednak na uwadze, że w wyjątkowych przypadkach tej postaci WNT może się ona nie ujawnić w badaniu przesiewowym, a dopiero w kolejnych tygodniach życia.
Piśmiennictwo
1. Madison L.D., LaFranchi S.; Screening for congenital hypothyroidism: current controversies; Curr. Opin. Endocrinol. Diabetes 2005:12, 36-41
2. Kumorowicz-Czoch M., Tylek-Lemańska D., Starzyk J.; Thyroid dysfunctions in children detected in mass screening for congenital hypothyroidism; J. Ped. Endocrinol. Metab. 2011:24, 3-4, 141-145
3. ; Working Group for Neonatal Screening in Paediatric Endocrinology of the European Society for Paediatric Endocrinology. Revised guidelines for neonatal screening programmes for primary congenital hypothyroidism; Horm. Res. 1999:52, 49-52
4. Raymond J., LaFranchi S.H.; Fetal and neonatal thyroid function: review and summary of significant new findings; Curr. Opin. Diabetes Obes. 2010:17, 1-7
5. Grüters A., Krude H.; Update on the Managment of Congenital Hypothyroidism; Horm. Res. 2007:68, 107-111
6. Fisher D.A.; Management of Congenital Hypothyroidism; J. Clin. Endocrinol. Metab. 1991:72, 523-529
7. Brown R.S.; The Thyroid. In Brook’s Clinical Pediatric Endocrinology, 6th edition. Edited by C. Brook, P. Clyton, R. Brown; Blackwell Publishing 2009
8. Brown R.S., Bellisario R.E., Botero D. et al.; Incidence of Transient Congenital Hypothyroidism due to Maternal Thyrotropin Receptor-Blocking Antibodies in Over One Million Babies; J. Clin. Endocrinol. Metab. 1996:81, 1147-115
9. Francis G., Riley W.; Congenital familial transient hypothyroidism secondary to transplacental thyrotropin-blocking autoantibodies; Am. J. Dis. Child. 1987:141, 1081-1083
10. Matsuura N., Yamada Y., Nohara Y. et al.; Familial neonatal transient hypothyroidism due to maternal TSH-binding inhibitor immunoglobulins; N. Engl. J. Med. 1980:303, 738-741
11. Connors M.H., Styne D.M.; Transient neonatal “athyreosis” resulting from thyrotropin-binding inhibitory immunoglobulins; Pediatrics 1986:78, 287-290
12. Mengreli C., Maniati-Christidi M., Kanaka-Gantenbein C. et al.; Transient congenital hypothyroidism due to maternal thyroid disease; Hormones (Athens) 2003:2, 113-119
13. Dussault J.H.., Fisher D.A.; Thyroid function in mothers of hypothyroid newborns; Obstet. Gynecol. 1999:93, 15-20
14. Azzopardi P., Forrester M., Ehtisham S.; Three siblings with self-resolving congenital hyperthyrotropinaemia secondary to thyrotropin receptor blocking antibodies; J. Paediatr. Child. Health 2010:46, 439-441
15. Pop V.I., Kuijpens J.L., van Baar A.L. et al.; Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy; Clin. Endocrinol. 1999:50, 149-155
16. Parks J.S., Lin M., Grosse S.D. et al.; The Impact of Transient Hypothyroidism on the Increasing Rate of Congenital Hypothyroidism in the United States; Pediatrics 2010:125, 54-63
17. Abalovich M., Amino N., Barbour L.A. et al.; Management of Thyroid Dysfunction during Pregnancy and Postpartum: An Endocrine Society Clinical Pratice Guideline; J. Clin. Endocrinol. Metab. 2007:92, 1-47
18. Kumorowicz-Czoch M., Starzyk J.; Noworodek matki z chorobą tarczycy – bezpieczny czy zagrożony?; Przegląd Lekarski 2010:67, 11, 1205-1209








