Endokrynol. Ped. 11/2012;2(39):9-16
DOI: 10.18544/EP-01.11.02.1377
Ocena związku pomiędzy surowiczymi stężeniami końcowych produktów glikacji (AGEs) i transformującego czynnika wzrostu – beta 1 (TGF-β1) a występowaniem mikroangioaptii u dzieci i młodzieży chorujących na cukrzycę typu 1
1Zakład Endokrynologii Klinicznej i Doświadczalnej, Instytut Medycyny Morskiej i Tropikalnej
2Zakład Immunologii
3Katedra i Klinika Chorób Oczu
Słowa kluczowe: cukrzyca typu 1, AGEs, TGF-β1, dzieci i młodzież, mikroangiopatia
Streszczenie
Celem badania była ocena związku pomiędzy surowiczymi stężeniami końcowych produktów glikacji (AGEs) oraz transformującego czynnika wzrostu – beta 1 (TGF-β1) a występowaniem mikroangiopatii cukrzycowej u młodych pacjentów chorujących na cukrzycę typu 1. Materiał i metody. Badaniem objęto 23 pacjentów w wieku 14.6 ± 3.8 lat z rozpoznaną mikroangiopatią cukrzycową ze średnim czasem trwania cukrzycy 7.7 ± 3.6 lat oraz 51 pacjentów bez mikroangiopatii w wieku 13.7 ± 2.9 lat ze średnim czasem trwania choroby 3.9 ± 2.4 lat. Grupę kontrolną stanowiły 24 zdrowe osoby w wieku 14.7 ± 2.1 lat. U wszystkich badanych oznaczono dobowe wydalanie albumin w moczu, poziom hemoglobiny glikozylowanej (HbA1c), C-peptydu, białka C-reaktywnego (CRP) w surowicy krwi, a także przeprowadzono badanie okulistyczne oraz 24-godzinny pomiar ciśnienia tętniczego. Ponadto u wszystkich badanych oznaczono stężenia AGEs w surowicy metodą ELISA oraz TGF-β1 metodą CBA (cytometric bead array). Wyniki. Grupa pacjentów z T1DM oraz mikrangiopatią cukrzycową charakteryzowała się statystycznie znamiennym wyższym poziomem w surowicy AGEs (22.771 ± 6.916 pg/ml vs. 15. 977 ± 4.943 pg/ml, p=0.002) oraz TGF-β1 (1.051± 550.0 pg/ml 539.0 ± 219.0 pg/ml, p=0.003) w porównaniu do grupy pacjentów bez mikroangiopatii. Porównując grupę pacjentów bez mikroangiopatii w porównaniu do grupy kontrolnej wykazaliśmy również istotnie znamienny wyższy surowiczy poziom AGEs (15.977 ± 4.943 pg/ml vs. 7.123 ± 2.546 pg/ml, p=0.000001) oraz TGF-β1 (539.0 ± 219.0 pg/ml vs. 167.0 ± 52.0, p=0.001). Analiza jednoczynnikowa wykazała istotną zależność pomiędzy poziomem AGEs w surowicy a wiekiem (r=0.41, p=0002), czasem trwania choroby (r=0.29, p=0.006), HbA1c (r=0.24, p=0.029), CRP (r=0.29, p=0.0005) oraz TGF-β1 (r=0.37, p=0.004). Wnioski. Wyniki naszych badań wskazują, że AGEs mogą być istotnym czynnikiem odpowiedzialnym za wzrost poziomu zarówno wyrównania metabolicznego, jak i TGF-β1, co w konsekwencji może prowadzić do rozwoju i progresji późnych powikłań mikronaczyniowych dzieci i młodzieży chorujących na cukrzycę typu 1
Wstęp
Mikroangiopatia cukrzycowa jest jednym z podstawowych przewlekłych powikłań cukrzycy. Charakteryzuje się typowymi zmianami morfologicznymi i czynnościowymi w obrębie drobnych naczyń krwionośnych. W przebiegu mikroangiopatii cukrzycowej najważniejsze klinicznie zmiany zachodzą w obrębie naczyń siatkówki, nerek, oraz układu nerwowego [1–3]. Powszechnie przyjmuje się, że hiperglikemia odgrywa decydującą rolę w patomechanizmie mikroangiopatii cukrzycowej [3–5]. Mikroangiopatia obejmuje charakterystyczne dla cukrzycy zmiany w obrębie układu naczyń włosowatych oraz w najdrobniejszych tętniczkach i żyłach, których średnica nie przekracza 100 µm. W przebiegu tego procesu następują charakterystyczne zmiany w postaci pogrubienia błony podstawnej ze zwiększeniem jej przepuszczalności, zanik perycytów prowadzący do zwiotczenia ściany naczynia i uwypukleń w postaci mikrotętniaków oraz rozplem komórek śródbłonkowych powodujący niedrożność i obliterację włośniczek. Klinicznie ujawniają się one jako retinopatia, nefropatia i neuropatia zarówno układu somatycznego, jak i wegetatywnego [2–4]. Jednakże, pomimo prowadzonych licznych prac badawczych, brak jest jednoznacznych poglądów wyjaśniających związek między wysokim stężeniem glukozy we krwi a rozwojem mikroangiopatii. Z większości doniesień wynika, że działanie uszkadzające odbywa się przez aktywację kilku szlaków metabolicznych, przy czym za najważniejszy uważa się nieenzymatyczną glikację białek [6–7]. Jej efektem jest powstanie końcowych produktów glikacji (ang. advanced glycation endproducts – AGEs) [8–10]. AGEs to reaktywna, heterogenna grupa związków, która powstaje w wyniku procesu przyłączania się reszt cukrowych do białek, lipidów oraz kwasów nukleinowych [11]. AGEs są produktami trwałymi, nieodwracalnymi, a ich cechą charakterystyczną jest zdolność tworzenia wiązań krzyżowych, które prowadzą do wzrostu sztywności białek [5,9]. Wysokospolimeryzowane i usieciowane białka tracą swoje biologiczne funkcje, są częściowo oporne na degradację proteolityczną, co utrudnia ich usuwanie z komórek i tkanek [9,11]. Kumulacja takich produktów w postaci złogów powoduje usztywnienie ścian drobnych naczyń [12]. W świetle badań Roy i wsp. oraz Rojas i wsp., glikacja nasila się w stanie ostrej i przewlekłej glikemii, co wykazano u pacjentów z cukrzycą typu 1 [5,7]. Co więcej, o poziomie AGEs w ustroju decyduje nie tylko szybkość ich wytwarzania, ale również tempo ich usuwania. W warunkach homeostazy podlegają one rozkładowi proteolitycznemu w lizosomach komórek. Produkty degradacji są wydzielane do krążenia i wydalane z moczem [10]. Pewna ilość AGEs może być usuwana z krążenia przez wątrobę – komórki Borowicza-Kupffera i śródbłonek [9].
Autorzy w ostatnich latach coraz częściej podkreślają udział cytokin oraz czynników wzrostu w rozwoju i progresji mikroangiopatii cukrzycowej [13–15]. Również wyniki naszych dotychczasowych badań wskazują na istotną rolę TNF-α [16–17], IL-6 [17], VEGF165 [17–18] oraz IL-12 [18] w patogenezie mikroangiopatii cukrzycowej u dzieci i młodzieży chorującej na cukrzycę typu 1 (T1DM). Transformujący czynnik wzrostu (TGF) należy do grupy czynników odpowiedzialnych m.in. za wzrost, różnicowanie, migrację komórek, formowanie i degradację składników macierzy zewnątrzkomórkowej, procesy chemotaksji oraz apoptozy [19]. Cytokina ta występuje w postaci 5 izoform, spośród których trzy, tj. TGF-beta 1, TGF-beta 2, TGF-beta 3 kodowane są przez różne geny. Najlepiej poznaną spośród nich jest TGF-beta 1, którą wytwarzają komórki dendrytyczne, leukocyty i komórki NK [19–20]. Zwiększone stężenie TGF-β1 i nadmierną ekspresję mRNA dla TGF-β1 obserwuje się w modelach zwierzęcych, jak też u pacjentów z nefropatią cukrzycową [21–23]. Badania ostatnich lat sugerują, że na wydzielanie TGF-β1 mogą mieć także wpływ AGEs [24–25]. Jednakże nie spotkaliśmy takich badań u dzieci i młodzieży z długotrwałą cukrzycą typu 1. W naszej pracy podjęliśmy więc próbę oceny związku pomiędzy surowiczymi stężeniami AGEs oraz TGF-β1 z występowaniem mikroangioaptii u dzieci i młodzieży chorujących na T1DM.
Materiały i metody
Badani pacjenci
Przebadano 23 pacjentów z długotrwałą cukrzycą typu 1 z mikroangiopatią w wieku 14.6 ± 3.8 lat ze średnim czasem trwania cukrzycy 7.7 ± 3.6 lat oraz 51 bez mikroangiopatii w wieku 13.7± 2.9 lat z czasem trwania cukrzycy 3.9±2.4 lat. Z 23 pacjentów, u których stwierdzono mikroangiopatię, u 21 zdiagnozowano nefropatię cukrzycową, u 16 rozpoznano retinopatię nieproliferacyjną, natomaist u 8 pacjentów stwierdzono nadciśnienie tętnicze. Badani pacjenci byli leczeni na oddziale Diabetologii Dziecięcej Katedry i Kliniki Pediatrii, Hematologii, Onkologii i Endokrynologii Gdańskiego Uniwersytetu Medycznego. T1DM została rozpoznana na podstawie stanowiska Polskiego Towarzystwa
Diabetologicznego [26]. Pacjenci byli leczeni insulinami humanizowanymi, w dawce 0.87 ± 0.23 j/kg masy ciała na dobę. Grupę kontrolną stanowiło 24 zdrowych dzieci i młodzieży w wieku 13.5±3.4 lat. Na realizację badania uzyskano zgodę prawnych opiekunów badanych pacjentów, jak też zgodę Niezależnej Komisji Bioetycznej d/s Badań Naukowych przy Gdańskim Uniwersytecie Medycznym (NKEBN/204/2009).
Poziom białka C-reaktywnego (CRP) oznaczono wysokoczułym testem ELISA (HsCRP firmy Dade Behring, USA). U wszystkich pacjentów oceniono dobowe wydalanie albumin w moczu metodą immunoturbidimetryczną przy użyciu testu Tina-quant® (Boehringer Mannheim GmbH, Germany). Jako albuminurię określono wydalanie albumin w moczu w granicach 30–299 mg/dobę w dwóch spośród trzech dobowych próbek jałowego moczu, zebranego na przestrzeni 6 miesięcy od chorych z wyrównaną cukrzycą bez cech klinicznych i laboratoryjnych kwasicy ketonowej. Ponadto wykonano 24-godzinny pomiar ciśnienia tętniczego za pomocą metodą Holtera (ABPM). Średnie wartości ciśnienia tętniczego oceniono w oparciu o siatki centylowe [27]. Stopień wyrównania metabolicznego cukrzycy oceniono na podstawie stężenia hemoglobiny glikowanej (HbA1c) oznaczonego w surowicy metodą immunoturbidimetryczną, używając Unimate 3 set (Hoffmann-La Roche AG, Basel, Szwajcaria). Badanie dna oka przeprowadzono po podaniu kropli 1% Sol. Tropicaid, soczewką +90D firmy (Okular Instruments – USA). Oceny przedniego odcinka gałki ocznej dokonano lampą szczelinową (Topcon SL-8Z – Japonia). U pacjentów chorujących dłużej niż 5 lat oraz po uprzednim badaniu dna oka wykonano angiografię fluresceinową (FL-A) kamerą cyfrową Topcon Imagenet 2000 (Japonia). Analizę obrazu dna oczu badanych dzieci przeprowadzono wg obowiązującej klasyfikacji [28].
Uzyskanie surowic
Od wszystkich pacjentów pobrano 2 ml krwi żylnej do probówek niezawierających koagulantu. Wszystkie pobrania wykonano przy okazji innych badań biochemicznych. Krew poddano wirowaniu przy prędkości 2500 obrotów/min (3K15, 4K15 Sigma, USA) przez 15 min. Tak uzyskana surowica została rozporcjowana do sterylnych plastikowych probówek o pojemności 1,5 ml w ilości około 500 µl. Surowice zamrożono i przechowywano do dalszej analizy w temperaturze – 70°C (zamrażarka POLAR 550H).
Pomiary poziomu AGEs oraz TGF-β1 w surowicy
Stężenie AGEs w surowicy oznaczono metodą immunoenzymatyczną (ELISA) przy użyciu zestawu Quantikine® firmy R&D Systems (USA), według instrukcji podanej przez producenta. Odczytu pomiaru absorbancji dokonano przy pomocy czytnika Bio-Tek FL600 (Bio-Tek Instruments, Inc. USA) przy długości fali λ=450 nm. Czułość metody wynosiła 24 pg/ml. Stężenie TGF-β1 oznaczano w surowicy krwi metodą CBA (cytometric bead array). Human TGF-β1 Single Plex Flex Set (Becton Dickinson, USA), według instrukcji podanej przez producenta. Próbki odczytywano w cytometrze przepływowym LSRII z użyciem oprogramowania FACSDiva (Becton Dickinson, USA). Przed odczytem dokonano kalibracji cytometru za pomocą kulek kalibracyjnych dostępnych w teście (Cytometer Setup Beads). Na podstawie obrazu FSS/SS bramkowano kulki i odczytywano fluorescencje. Analizę wykonano za pomocą oprogramowania FCAP Array Software (Becton Dickinson, USA).
Analiza statystyczna
Analiza statystyczna została przeprowadzona przy użyciu pakietu statystycznego StatSoft, Inc. (2010), STATISTICA version 9.0. www.statsoft.com. Do porównania badanych grup użyto testów nieparametrycznych Kruskala-Wallisa lub ANOVA. Przeprowadzono również analizę korelacji Pearsona surowiczych poziomów AGE z innymi parametrami klinicznymi. Za poziom istotności statystycznej przyjęto p<0.05.
Wyniki
Charakterystyka kliniczna badanych
Z 23 pacjentów, u których stwierdzono obecność mikroangiopatii, u 21 zdiagnozowano nefropatię cukrzycową, u 16 rozpoznano retinopatię
nieproliferacyjną, natomiast u 8 pacjentów stwierdzono nadciśnienie tętnicze. Charakterystykę badanych parametrów przedstawiono w tabeli I.
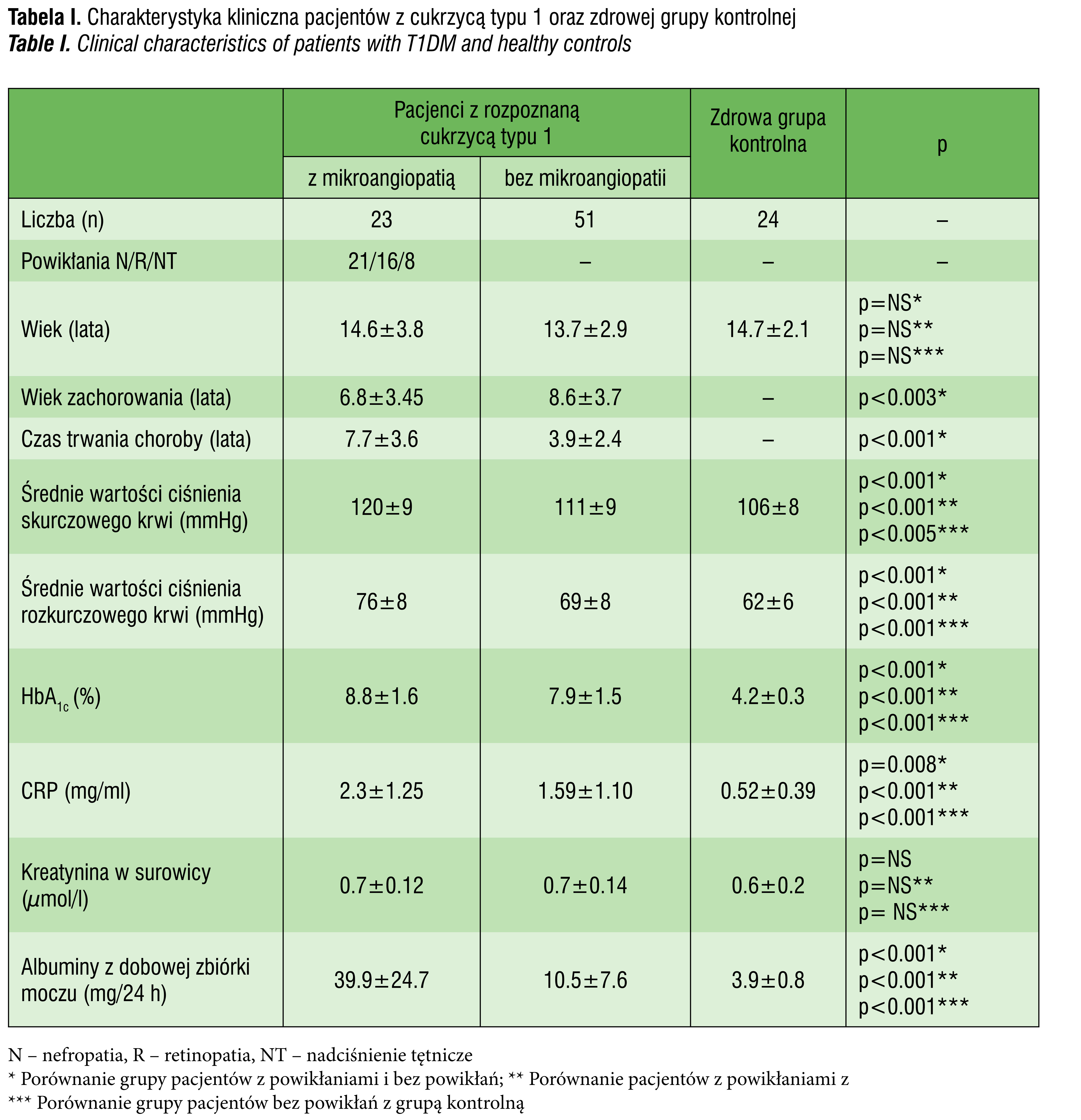
Badani chorzy z T1DM i z rozpoznaną mikroangiopatią cukrzycową w porównaniu do chorych bez mikroangiopatii charakteryzowali się statystycznie znamiennym dłuższym czasem trwania choroby, statystycznie znamiennym wyższym poziomem HbA1c, CRP, wyższym dobowym wydalaniem albumin z dobowej zbiórki moczu oraz znamiennie wyższym ciśnieniem skurczowym i rozkurczowym. Różnice te były także znamienne statystycznie w porównaniu do zdrowej grupy kontrolnej. Natomiast nie wykazano różnic znamiennie statystycznych pomiędzy grupami w poziomie kreatyniny w surowicy. Z kolei, porównując grupę pacjentów bez mikroangiopatii, wykazano istotnie znamienny wyższy poziom HbA1c, CRP, wyższe dobowe wydalanie albumin z dobowej zbiórki moczu oraz znamiennie wyższe ciśnienie skurczowe, jak też rozkurczowe krwi w porównaniu z badaną zdrową grupa kontrolną.
Surowicze poziomy AGEs oraz TGF-β1
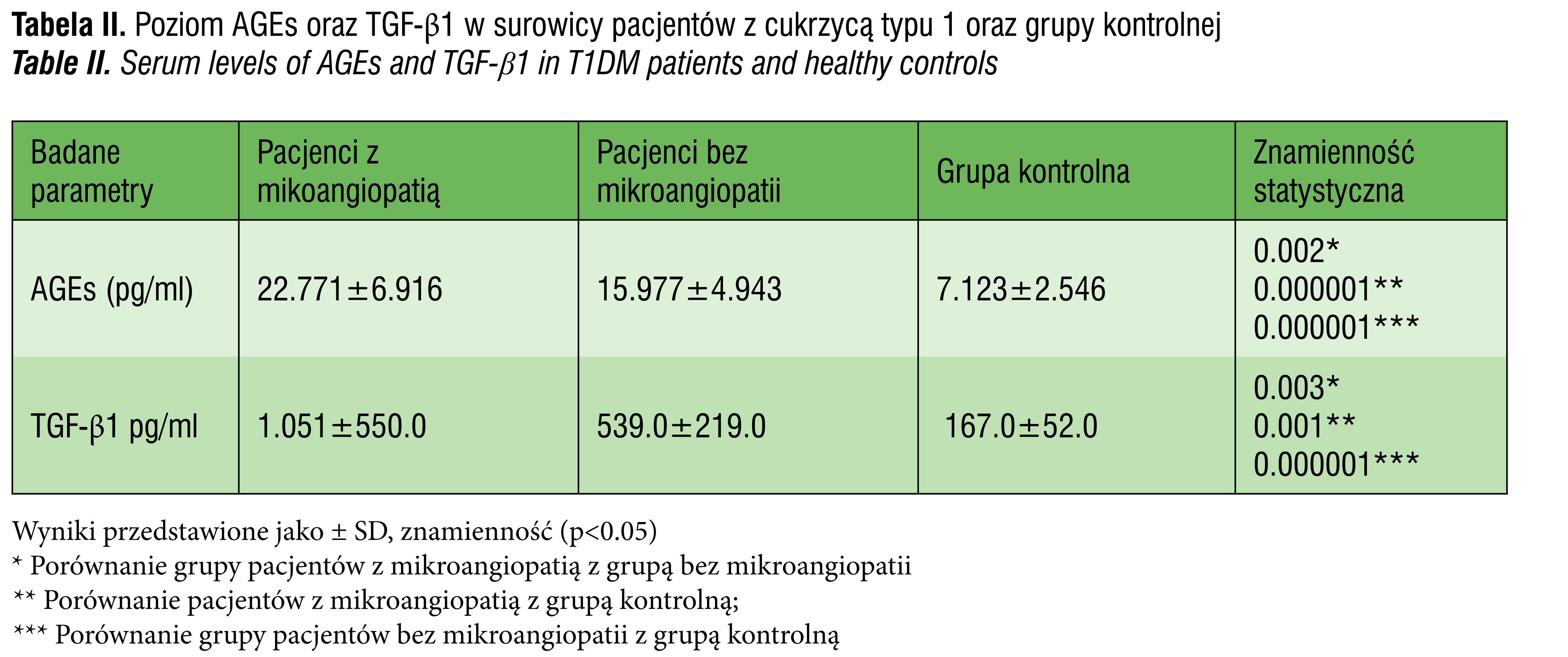
Grupa pacjentów z cukrzycą typu 1 oraz mikroangiopatią cukrzycową charakteryzowała się statystycznie znamiennym wyższymi surowiczymi stężeniami AGEs (22.771 ± 6 .916 pg/ml vs. 15.977 ± 4.943 pg/ml, p=0.002) oraz TGF-β1 (1.051 ± 550 pg/ml 539.0 ± 219.0 pg/ml, p=0.003) w porównaniu do grupy pacjentów bez mikroangiopatii. Porównując grupę pacjentów bez mikroangiopatii do grupy kontrolnej wykazaliśmy również istotnie znamienny wyższy surowiczy poziom AGEs (15.977 ± 4.943 pg/ml vs 7.123 ± 2.546 pg/ml, p=0.000001) oraz TGF-β1 (539.0 ± 219.0 pg/ml vs 167.0 ± 52.0, p=0.001) (tab. II).
Korelacje pomiędzy stężeniami AGEs a badanymi parametrami w grupie pacjentów z mikroangiopatią
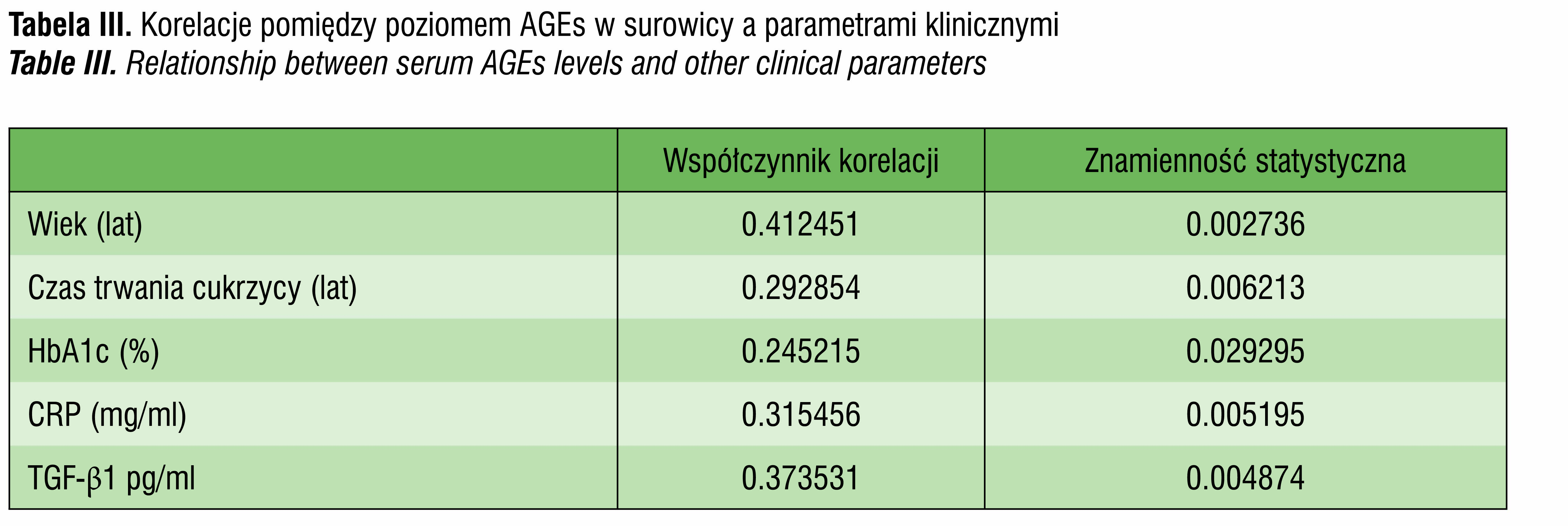
W badanej grupie pacjentów z mikroangiopatią wykazano dodatnią statystycznie znamienną korelację pomiędzy surowiczymi poziomami AGEs a wiekiem (r=041, p=0002), czasem trwania choroby (r=0.29, p=0.006), stężeniem HbA1c (r=0.24, p=0.029), białkiem C-reaktywnym (r=0.31, p=0.0005) oraz z TGF-β1 w surowicy (r=0.37, p=0.004) (tab. III).
Dyskusja
Przewlekłe powikłania cukrzycy stanowią pogorszenie jakości życia, a także główną przyczynę inwalidztwa [29–30]. Mimo prowadzonych licznych prac badawczych brak jest natomiast jednoznacznych poglądów określających przyczyny występowania mikroangiopatii u młodych pacjentów z T1DM [1,4,13]. Wyniki przeprowadzonego przez nas badania wskazują na istotnie wyższy poziom AGEs w surowicy u dzieci z T1DM oraz mikroangiopatią w porównaniu do grupy pacjentów z T1DM bez powikłań naczyniowych, jak też w porównaniu do zdrowej grupy kontrolnej. Nasze wyniki są zgodne z badaniami włoskich badaczy (Chiarelli i wsp.), w których wykazano najwyższe poziomy AGEs u dzieci i młodzieży z powikłaniami mikronaczyniowymi, natomiast niższe u dzieci i młodzieży bez powikłań cukrzycowych, a najniższe w zdrowej grupie kontrolnej [31]. Autorzy sugerują, że wysokie stężenia AGEs mogą brać udział w rozwoju przewlekłych powikłań cukrzycowych. Również autorzy: Galler i wsp. [32] oraz Kostolanska i wsp. [33] wykryli wyższe poziomy AGEs u dzieci z T1DM w porównaniu do grupy kontrolnej oraz zaobserwowali dodatnią korelację z czasem trwania choroby, jak też surowiczymi poziomami HbA1c. W naszym badaniu także zaobserwowaliśmy dodatnią korelację pomiędzy poziomem AGEs w surowicy a wiekiem, czasem trwania choroby a surowiczym poziomem HbA1c. W dotychczasowych badaniach wykazano, że wraz z wiekiem zawartość AGEs w tkankach i płynach ustrojowych wzrasta. Uważa się, że jedną z prawdopodobnych przyczyn tego zjawiska jest zmniejszone usuwanie AGEs z organizmu [34]. Co więcej, Lyons i wsp. [3], Bragd i wsp. [35] oraz McCarter i wsp. [36] zaobserwowali, że nieenzymatycznej glikacji podlega m.in. hemoglobina, a proces ten jest zależny od wewnątrzkomórkowego stężenia glukozy oraz czynników regulującymi wiązanie glukozy z hemoglobiną. Badacze ci wykazali, że czynniki odpowiedzialne za zmienność biologiczną procesów nieenzymatycznej glikacji hemoglobiny mogą wpływać również na indywidualną skłonność do rozwoju późnych powikłań naczyniowych [35–36]. Wyniki naszych badań wykazały także dodatnią korelację pomiędzy AGE a surowiczym poziomem białka C-reaktywnego w grupie pacjentów z mikroangiopatią. Badacze dysponują coraz większą liczbą dowodów na istnienie przewlekłego procesu zapalnego o niewielkim nasileniu w przebiegu rozwoju i progresji późnych powikłań naczyniowych [17,37–38]. Zarówno nasze badania, jak też innych autorów wskazują na ścisły związek między wykładnikami stanu zapalnego, takimi jak na przykład stężenie białka C-reaktywnego a nasileniem mikroangiopatii cukrzycowej [37–38]. Mechanizmy prowadzące do rozwoju nefropatii cukrzycowej nie są do końca wyjaśnione. W ostatnich latach zwraca się uwagę na współudział obok czynników hemodynamicznych i biochemicznych również na zaangażowanie układu immunologicznego [1,3–4,16–18]. Badania ostatnich lat podtrzymują hipotezę, że czynniki wzrostu, w szczególności czynnik wzrostu śródbłonka naczyniowego (VEGF), insulinopodobny czynnik wzrostu-1 (IGF-1) oraz TGF-β są związane z rozwojem mikroangiopatii cukrzycowej [14,24,39]. Jednakże, dotychczas ukazało się niewiele publikacji odnośnie do TGF-β1 u dzieci i młodzieży z cukrzycą typu 1, a otrzymane wyniki badań nie są spójne [40–42]. Stechowa et al. wykryli wysoki poziom TGF-β1 u pacjentów ze świeżo rozpoznaną T1DM [40]. Natomiast inny zespół (Halminen i wsp.) wykazał niższą ekspresję TGF-β1 w jednojądrzastych komórkach krwi obwodowej u dzieci ze świeżo rozpoznaną cukrzycą typu 1 [41]. Z kolei Korpinen i wsp. [42] wykryli wyższe poziomy TGF-β1 w moczu oraz w komórkach PBMC u młodych pacjentów z nefropatią w porównaniu ze zdrową grupa kontrolną, sugerując, że podwyższony poziom TGF-β1 u tych pacjentów może być związany z niewydolnością nerek [42]. My w swoich obecnych badaniach przez zastosowanie analizy statystycznej jednoczynnikowej wykazaliśmy istnienie związku między AGEs a surowiczym poziomem TGF-β1 u badanych pacjentów z mikroangiopatią. W świetle badań Rashid i wsp. oraz Zhang i wsp., związanie AGEs z receptorami na komórkach mezangialnych, śródbłonkowych oraz w makrofagach kłębuszka nerkowego nasila wytwarzanie cytokin, czynników wzrostu, zwłaszcza TGF-β1. Prowadzi to do zwiększenia syntezy lamininy, fibronektyny oraz kolagenu [43–44]. Kolagen jest białkiem najdłużej pozostającym w organizmie, które, ulegając glikacji, zwiększa liczbę wiązań krzyżowych w swej strukturze [43]. Efektem tego jest zwiększona sztywność włókien kolagenowych, zmniejszona ich rozpuszczalność i obniżona podatność kolagenu na trawienie enzymatyczne [43–44]. Przewlekłe wydzielanie TGF-β1 powoduje nadmierne gromadzenie macierzy zewnątrzkomórkowej i włóknienie. Taką prawidłowość wykazano w badaniach doświadczalnych, w których autorzy zaobserwowali, że to miejscowa nadprodukcja TGF-β1 w obrębie kłębka nerkowego prowadzi do jego włóknienia [25].
Wyniki naszych badań wskazują, że AGEs mogą być istotnym czynnikiem odpowiedzialnym za wzrost poziomu wyrównania metabolicznego, jak też TGF-β1, co w konsekwencji może prowadzić do rozwoju i progresji mikroangiopatii cukrzycowej.
Podziękowania: Badania były wykonane w Zakładzie Immunologii Gdańskiego Uniwersytetu Medycznego, kierownik Zakładu Immunologii GUMed – prof. dr hab. med. Jolanta Myśliwska
Piśmiennictwo
1. Kaminska-Winciorek G., Deja G., Polańska J., Jarosz-Chobot P.; Diabetic microangiopathy in capillaroscopic examination of juveniles with diabetes type 1; Postępy Hig Med Dośw. 2012:66, 51-59
2. Abe H., Matsubara T., Arai H., Doi T.; Role of Smad1 in diabetic nephropathy: Molecular mechanisms and implications as a diagnostic marker; Histol Histopathol. 2011:26, 531-541
3. Lyons T.J., Basu A.; Biomarkers in diabetes: hemoglobin A1c, vascular and tissue markers; Transl Res. 2012:159, 303-312
4. Kołłątaj W., Szweczyk L.; Zastosowanie nowego testu termometrycznego w ocenie późnych powikłań cukrzycy typu 1; Endokrynologia Pediatryczna 2002:1, 27-35
5. Roy S., Trudeau K., Roy S. et al.; New insights into hyperglycemia-induced molecular changes in microvascular cells; J. Dent. Res. 2010:89, 116-127
6. Sheetz M.J., King G.L.; Molecular understanding of hyperglycemia´s adverse effects for diabetic complications; JAMA 2002:288, 2579-2588
7. Rojas A., Morales M.A.; Advanced glycation and endothelial functions: a link towards vascular complications in diabetes; Life Sci. 2004:76, 715-730
8. Cho S.J., Roman G., Yeboah F., Konishi Y.; The road to advanced glycation end products: a mechanistic perspective; Curr. Med. Chem. 2007:14, 1653-1671
9. Wa C., Cerny R.L., Clarke W.A., Hage D.S.; Characterization of glycation adducts on human serum albumin by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry; Clin. Chim. Acta. 2007:385, 48-60
10. Ahmed N., Thornalley P.J.; Advanced glycation endproducts: what is their relevance to diabetic complications?; Diabetes Obes. Metab. 2007:9, 233-245
11. Monnier V.M.; Intervention against the Maillard reaction in vivo; Arch. Biochem. Biophys. 2003:419, 1-15
12. Miura J., Uchigata Y., Yamamoto Y. et al.; AGE down-regulation of monocyte RAGE expression and its association with diabetic complications in type 1 diabetes; J. Diabetes Complications 2004:18, 53-59
13. Wu C.C., Sytwu H.K., Lin Y.F.; Cytokines in diabetic nephropathy; Adv. Clin. Chem. 2012:56, 55-74
14. Peczyńska J., Urban M., Urban B. et al.; Assessment of growth factor levels in adolescents with type 1 diabetes mellitus and the beginning of diabetic microangiopathy; Pediatr. Endocrinol. Diabetes. Metab. 2004:10, 41-48
15. Stawerska R., Smyczyńska J., Lewiński A. et al.; Ocena zależności pomiędzy wydzielaniem greliny, hormonu wzrostu i insulinopodobnego czynnika wzrostowego I u dzieci z niedoborem wzrostu; Endokrynologia Pediatryczna 2009:4, 9-16
16. Zorena K., Myśliwska J., Myśliwiec M. et al.; Serum TNF-alpha level predicts nonproliferative diabetic retinopathy in children; Mediators Inflamm. 2007, 92196
17. Myśliwiec M., Balcerska A., Zorena K. et al.; The role of vascular endothelial growth factor, tumor necrosis factor alpha and interleukin-6 in pathogenesis of diabetic retinopathy; Diabetes Res. Clin. Pract. 2008:79, 141-146
18. Zorena K., Myśliwska J., Myśliwiec M. et al.; Interleukin-12, vascular endothelial growth factor and tumor necrosis factor-alpha in the process of neoangiogenesis of diabetic retinopathy in children; Klin. Oczna. 2007:109, 155-159
19. Orlova V.V., Liu Z., Goumans M.J. et al.; Controlling angiogenesis by two unique TGF-β type I receptor signaling pathways; Histol Histopathol. 2011:26, 1219-1230
20. Lebrin F., Deckers M., Bertolino P. et al.; TGF-beta1 receptor function in the endothelium; Cardiovasc Res. 2005:65, 599-608
21. Iglesias-de la Cruz M.C., Ziyadeh F.N., Isono M.; Effects of high glucose and TGF-beta1 on the expression of collagen IV and vascular endothelial growth factor in mouse podocytes; Kidney Int. 2002:62, 901-913
22. Olivieri A., De Angelis S., Dionisi S. et al.; Serum transforming growth factor β1 during diabetes development in non-obese diabetic mice and humans; Clin. Exp. Immunol. 2010:162, 407-414
23. Brennan E.P., Morine M.J., Walsh D.W. et al.; Next-generation sequencing identifies TGF-β1-associated gene expression profiles in renal epithelial cells reiterated in human diabetic nephropathy; Biochim Biophys Acta. 2012:1822, 589-599
24. Schrijvers B.F., De Vriese A.S., Flyvbjerg A.; From hyperglycemia to diabetic kidney disease: the role of metabolic, hemodynamic, intracellular factors and growth factors/cytokines; Endocrine Review. 2004:25, 971-1010
25. Ho C., Lee P.H., Hsu Y.C. et al.; Sustained Wnt/β-Catenin Signaling Rescues High Glucose Induction of Transforming Growth Factor-β1-Mediated Renal Fibrosis; Am. J. Med. Sci. 2012:20 Jan [Epub ahead of print]
26. ; Zalecenia kliniczne dotyczące postępowania u chorych na cukrzycę. Stanowisko Polskiego Towarzystwa Diabetologicznego; Diabetologia Praktyczna 2011:12, supl. A
27. ; The fourth report on the diagnosis, evaluation and treatment of high blood pressure in children and adolescent; Pediatrics 2004:114, Suppl. 24th Report: 555-576
28. ; Early Treatment Diabetic Retinopathy Study Research Group. Classification of diabetic retinopathy from fluorescein angiograms: ETDRS report number 11; Ophthalmology 1991:98, (Suppl), 807-822
29. Grauslund J.; Long-term mortality and retinopathy in type 1 diabetes; Acta Ophthalmol. 2010:88, Thesis1:1-14
30. Cho Y.H., Craig M.E., Hing S. et al.; Microvascular complications assessment in adolescents with 2- to 5-yr duration of type 1 diabetes from 1990 to 2006; Pediatr. Diabetes. 2011:12, 682-689
31. Chiarelli F., Catino M., Tumini S. et al.; Advanced glycation end products in adolescents and young adults with diabetic angiopathy; Pediatr. Nephrol. 2000:14, 841-846
32. Galler A., Müller G., Schinzel R. et al.; Impact of metabolic control and serum lipids on the concentration of advanced glycation end products in the serum of children and adolescents with type 1 diabetes, as determined by fluorescence spectroscopy and epsilon-(carboxymethyl)lysine; Diabetes Care 2003:26, 2609-2615
33. Kostolanska J., Jakus V., Barak L.; Monitoring of early and advanced glycation in relation to the occurence of microvascular complications in children and adolescents with type 1 diabetes mellitus; Physiol Res. 2009:58, 553-561
34. Balley A.J.; Molecular mechanisms of ageing in connective tissues; Mech. Ageing. Dev. 2011:122, 735-755
35. Bragd J., Adamson U., Bäcklund L.B., et al.; Can glycaemic variability, as calculated from blood glucose self-monitoring, predict the development of complications in type 1 diabetes over a decade?; Diabetes Metab. 2008:34, 612-616
36. McCarter R.J., Hempe J.M., Gomez R. et al.; Biological variation in HbA1c predicts risk of retinopathy and nephropathy in type 1 diabetes; Diabetes Care 2004:27, 1259-1264
37. Zorena K., Myśliwska J., Myśliwiec M. et al.; Czynniki zapalne i angiogenne u dzieci z retinopatią cukrzycową; Family Medicine & Primary Care Review 2007:9, 1007-1010
38. Głowińska-Olszewska B., Urban M., Peczyńska J. et al.; hsCRP protein in children and adolescents with diabetes type 1; Pediatr. Endocrinol. Diabetes. Metab. 2007:13, 79-84
39. Wedrychowicz A., Dziatkowiak H., Nazim J. et al.; Insulin-like growth factor-1 and its binding proteins, IGFBP-1 and IGFBP-3, in adolescents with type-1 diabetes mellitus and microalbuminuria; Horm Res. 2005:63, 245-245
40. Stechova K., Bohmova K., Vrabelova Z. et al.; High T-helper-1 cytokines but low T-helper-3 cytokines, inflammatory cytokines and chemokines in children with high risk of developing type 1 diabetes; Diabetes Metab. Res. Rev. 2007:23, 462-471
41. Halminen M., Simell O., Knip M. et al.; Cytokine expression in unstimulated PBMC of children with type 1 diabetes and subjects positive for diabetes-associated autoantibodies; Scand. J. Immunol. 2001:53, 510-513
42. Korpinen E., Teppo A.M., Hukkanen L. et al.; Urinary transforming growth factor-beta1 and alpha1-microglobulin in children and adolescents with type 1 diabetes; Diabetes Care 2000:23, 664-668
43. Rashid G., Benchetrit S., Fishman D. et al.; Effect of advanced glycation end-products on gene expression and synthesis of TNF-alpha and endothelial nitric oxide synthase by endothelial cells; Kidney Int. 2004:66, 1099-1106
44. Zhang M., Fraser D., Phillips A.; ERK, p38, and Smad signaling pathways differentially regulate transforming growth factor-beta1 autoinduction in proximal tubular epithelial cells; Am. J. Pathol. 2006:169, 1282-1293