Endokrynol. Ped. 13/2014;4(49):35-40
DOI: 10.18544/EP-01.13.04.1501
Cukrzyca typu 1 a zaburzenia funkcjonowania tkanki kostnej
1Wydział Pedagogiki i Psychologii – Pielęgniarstwo, WSEI w Lublinie; Klinika Endokrynologii i Diabetologii Dziecięcej, Uniwersytet Medyczny w Lublinie
2Klinika Endokrynologii i Diabetologii Dziecięcej, Uniwersytet Medyczny w Lublinie
Słowa kluczowe: cukrzyca typu 1, funkcjonowanie tkanki kostnej
Streszczenie
Relacje między metabolizmem tkanki kostnej a mechanizmami regulującymi gospodarkę węglowodanową nie wydają się bezpośrednie, choć nie są dostatecznie poznane, a przecież uważa się że tkanka kostna wykorzystuje znaczną pulę glukozy przyswajanej przez organizm. Prześledzono relacje między markerami kościotworzenia a działaniem insuliny, zachowanie tych markerów w przebiegu cukrzycy typu 1, równoległość procesów angiogenezy i osteogenezy oraz uwarunkowania osteopenii w cukrzycy typu 1
Relacje między metabolizmem tkanki kostnej a mechanizmami regulującymi gospodarkę węglowodanową nie są dostatecznie poznane i nie wydają się bezpośrednie i proste.
Jak wiadomo, kości są ciągle przebudowywane, zużytą tkankę kostną zastępuje nowa. Proces ten zachodzi przy pomocy dwu typów komórek: osteoblastów i osteoklastów. Osteoklasty mają zdolność rozpuszczania i resorpcji tkanki kostnej, co ma znaczenie w prawidłowym kształtowaniu się struktury kości. Osteoblasty wytwarzają zaś część organiczną macierzy kostnej, w której odkładają się związki fosforanów wapnia. Proces ten jest regulowany przez parathormon i wit. D.
Osteokalcyna i osteoprotegeryna/RANKL a trzustka
Osteokalcyna jest hormonem wytwarzanym przez osteoklasty, jej synteza zależna jest od wit. D i wit. K, stąd udział tych witamin w procesie kościotworzenia. Według Wei i wsp. [1] może ona mieć wpływ na metabolizm glukozy, uwalnianie insuliny i stymulację insulinowrażliwości. Badania tych autorów wskazują na potencjalny wpływ osteokalcyny na stymulację proliferacji komórek beta trzustki zarówno w okresie okołoporodowym, jak i u dorosłych. Z kolei niekarboksylowana gamma-osteokalcyna stymuluje komórki beta trzustki do sekrecji insuliny oraz zwiększa insulinowrażliwość tkanki tłuszczowej, mięśniowej i wątroby [2].
Insulina zaś posiada w obrębie osteoblastów receptory, których aktywacja prowadzi do stymulacji ich do produkcji osteokalcyny [3, 4]. Zatem aktywacja receptora insulinowego w osteoblastach pośrednio wpływa na procesy kościotworzenia [5, 6]. Połączenie insuliny z receptorem w osteoblastach doprowadza jednak również do obniżenia aktywności osteoprotegeryny i zwiększenia aktywności osteoklastów oraz resorpcji kości. Toteż obniżenie wartości osteoprotegeryny i zmiana stosunku OPG/RANKL sprzyjają aktywacji resorpcji [7].
Osteoprotegeryna (OPG), produkowana w wielu tkankach m.in. układu sercowo-naczyniowego, płucach, nerkach, kościach, warunkuje prawidłowe dojrzewanie i funkcjonowanie osteoklastów, bowiem wiążąc się z RANKL blokuje dojrzewanie, aktywację osteoklastów oraz wzmaga ich apoptozę [8–10]. Usunięcie genu OPG u myszy powoduje osteopenię i obniżenie mechanicznej wytrzymałości kości [11].
Białko typu RANKL (receptor activator of nuclear factor NF-kB ligand) stanowi czynnik aktywujący proces dojrzewania osteoklastów poprzez ich różnicowanie, funkcjonowanie oraz hamowanie ich apoptozy. Równowaga pomiędzy OPG a RANKL reguluje więc rozwój i aktywację osteoklastów, a tym samym reguluje metabolizm kości [8–10]. Warto przy tym pamiętać, że związek układu OPG/RANKL z układem immunologicznym ma zasadnicze znaczenie w patogenezie osteoporozy w przebiegu chorób autoimmunologicznych (m.in. cukrzyca typu 1) i zapalnych. Ekspresję OPG zmniejszają leki immunosupresyjne, a więc następuje wówczas aktywizacja osteoklastów [12, 13].
Niedobór innych hormonów a osteopenia
Jak wiadomo, w procesach kościotworzenia bierze udział parathormon, który aktywizuje komórki mezenchymy do różnicowania się w osteoklasty (kalcitonina hamuje ten proces); z kolei wit. D, od której w dużej mierze zależy synteza osteokalcyny, przyspiesza mineralizację substancji podstawowej kości. Warto także przypomnieć, że badania ostatnich lat wskazują na immunomodulacyjną rolę wit. D oraz jej obniżone poziomy u dzieci, zwłaszcza z nowo rozpoznaną cukrzycą typu 1, co może sugerować również jej inicjującą rolę w procesach autoimmunizacyjnych leżących u podłoża tej choroby, a także działanie ochronne na komórki beta i hamowanie ich dalszej destrukcji [14–16]. Niedobory wit. D równocześnie wpływają na słabą strukturę kości w rozpoznanej cukrzycy typu 1, co niewątpliwie ułatwia procesy osteopeniczne. Według Thrailkill i Fowlkesa [17] osteopatia cukrzycowa charakteryzuje się zmianami w mikroarchitekturze, które obniżają jakość kości, na co korzystny wpływ ma wit. D. Potwierdzają ten nieprawidłowy stan tkanki kostnej pogłębione badania Hameda i wsp. [18], dotyczące dzieci z cukrzycą typu 1. Wskazują one, że aktywność fizyczna i podawanie wit. D ma istotne znaczenie dla właściwego funkcjonowania tkanki kostnej w cukrzycy typu 1.
U chorych na cukrzycę typu 1 źle kontrolowanych wyraźnie zmniejsza się aktywność osteoblastów. Tworzenie macierzy kostnej jest zwolnione. W tej sytuacji dochodzi do rozkojarzenia obrotu metabolicznego w tkance kostnej i osteopenii (ryc. 1).
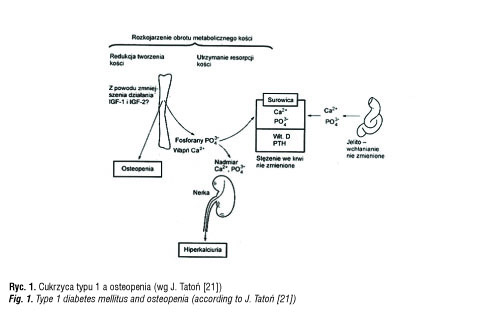
Zwłaszcza kwasica ketonowa zwiększa aktywność osteoklastów [19–21].
Przyczyny osteopenii w cukrzycy typu 1
Publikacje dotyczące zagadnienia osteopenii/osteoporozy u chorych na cukrzycę typu 1 podkreślają [19, 21] znaczenie wielu uwarunkowań:
• Stan kataboliczny spowodowany niedoborem insuliny zmniejsza tworzenie białek, a więc i białek macierzy kostnej oraz zmniejsza mineralizację kości. Jednak wczesne włączenie do leczenia insulinoterapii może regulować metabolizm białek.
• Stany kwasicy ketonowej zwiększają aktywność osteoklastów, ale są to stany szybko likwidowane w czasie intensywnej terapii
• Ograniczenia dietetyczne sprzyjają ujemnemu bilansowi azotu, wapnia, fosforanów. Nowoczesna edukacja dietetyczna stara się wdrożyć u pacjentów z cukrzycą typu 1 stosowanie właściwej diety.
• Nefropatia cukrzycowa dodatkowo wpływa na zmniejszenie wytwarzania 1,25dihydroksycholekalciferolu.
• Angiopatia cukrzycowa może upośledzać przepływ krwi w drobnych naczyniach kostnych i pogarszać odżywianie tkanki kostnej.
W efekcie zmniejszenie macierzy kostnej może prowadzić do zmniejszenia gęstości masy kostnej. Dotyczy to zwłaszcza osób z dłużej trwającą cukrzycą typu 1.
W związku jednak z coraz lepszym wyrównaniem metabolicznym cukrzycy typu 1 (preparaty insuliny i zbliżone do fizjologicznych warunków podawanie insuliny) u większości chorych wchłanianie Ca, P w jelicie i ich stężenie we krwi pozostaje niezmienione [21]. Tym samym w dobrze kontrolowanej cukrzycy typu 1 niebezpieczeństwo wczesnej osteopatii cukrzycowej wydaje się mniej prawdopodobne. Natomiast obserwacje m.in. Mathieu i wsp. [14] oraz Szewczyka i wsp. [15] potwierdziły niedobory wit. D u osób ze świeżo rozpoznaną cukrzycą typu 1, które mogą rzutować na funkcjonowanie tkanki kostnej.
Angiogenesis i osteogenesis
Interesująca, z punktu widzenia relacji między tkanką kostną a cukrzyca typu 1 wydaje się kwestia równoległości istotnych dla funkcjonowania tej tkanki procesów angiogenezy i osteogenezy, pomimo że nie do końca są poznane ich komórkowe i metaboliczne mechanizmy. Kości zaś są bogato unaczynioną tkanką i rozwój kości współistnieje z angiogenezą szkieletową. Kusumbe i wsp. [22] dokonali identyfikacji specyficznych komórek śródbłonka naczyń krwionośnych kości i ich sygnalnych wskaźników wskazujących na mechanizmy, poprzez które unaczynienie przyczynia się do budowy kości. Równoległy rozwój naczyń szkieletowych i osteogeneza sugerują obecność molekularnego, krzyżowego współdziałania pomiędzy śródbłonkiem a komórkami osteoblastów. Według badań Ramasamy i wsp. [23] rozwój naczyń w kości jest uwarunkowany wyspecjalizowanymi tkankowymi formami angiogenezy. Badania te wykazały obecność populacji komórek endotelialnych
w naczyniach, które są specyficzne dla kości i osteogenezy, mają istotne znaczenie w kształtowaniu się waskulatury kostnej (L-endotelium, H-endotelium) i tym samym w dojrzewaniu i regeneracji kości. Przy tym komórki kostne wytwarzają czynnik regulujący angiogenezę (głównie VEGF – vascular endothelial growth factor). Oczywiście wiele czynników może wpływać na mechanizmy angiogenezy, m.in. następstwa cukrzycy. Np. Shin i wsp.(24) obserwowali ścisłą zależność między podwyższonymi stężeniami osteoprotegeryny a dysfunkcją śródbłonka naczyń, co prawda u chorych na cukrzycę typu 2. Ale w cukrzycy typu 1 możemy się spodziewać większego ryzyka zaburzeń naczyniowych (mikroangiopatia cukrzycowa)
Cukrzyca typu 1 a ryzyko zaburzeń metabolizmu kostnego
W przebiegu cukrzycy typu 1 wiele czynników może wpływać na osłabienie struktury kostnej. Jak podają Jackuliak i Payer [25], ryzyko złamań jest sześciokrotnie większe niż u zdrowych osób i jest związane z mniejszą masą kostną. Maddaloni i wsp. [26] wykazali, że poziomy osteokalcyny zachowują się odwrotnie proporcjonalnie do stężeń hemoglobiny glikowanej i wartości BMI (bone mass index), potwierdzając hipotezę, że zła kontrola glikemii może wpływać na funkcję osteoblastów. Z kolei Saito i wsp. [27] stwierdzili, że nie tylko hiperglikemia, ale i stres oksydacyjny redukuje korzystne enzymatyczne relacje w obrębie tkanki kostnej (cross-links). Z badań Abd El Dayem i wsp. [28] wynika, że pacjenci z cukrzycą typu 1 charakteryzowali się niskimi wartościami BMI, słabą budową kości i wysokimi markerami resorpcji kości, Zaś obserwacje Maggio i wsp. [29] wykazały, ze u dzieci z cukrzycą typu 1 zachęconych do regularnej aktywności fizycznej poprawiła się wartość biomarkerów kostnych (osteokalcyna, kolagen typu 1) oraz szczytowa masa kostna, zapobiegając osteoporozie. Yaturu i wsp. [30], podkreślając znaczenie mechanizmów, które wpływają na funkcjonowanie tkanki kostnej, jak insulina, IGF-1, cytokiny, stopień glikacji białek i produkty glikacji a także równowaga wapniowo-fosforanowa, wykazali obniżone poziomy osteokalcyny w cukrzycy typu 1, zaś BMD (Bone mass density) podobną u chorych i zdrowych osób i niezależącą od wartości hemoglobiny glikowanej, czasu trwania cukrzycy, aktywności fizycznej, diety. Według obserwacji Camurdana i wsp. [31] hemoglobina glikowana i trwanie cukrzycy typu 1 są najważniejszymi determinantami BMD, zaś faza dojrzewania ma inne znaczenie, bowiem BMD jest niższa we wcześniejszych fazach dojrzewania w nowo rozpoznanej cukrzycy tego typu. Obserwacje Viny i wsp. [32] wykazały, że BMD wzrastała systematycznie u osób zdrowych i chorych na cukrzycę typu 1, ale była istotnie niższa u chorych, głównie w fazie skoku pokwitaniowego, Natomiast nie stwierdzili oni zależności pomiędzy kontrolą metaboliczna (HbA1c, zapotrzebowanie na insulinę), trwaniem cukrzycy a BMD.
Z kolei Saha i wsp. [33], prowadząc badania porównawcze u nastolatków chorych na cukrzycę typu 1, wykazali, że deficyty dotyczące tkanki kostnej wydają się dotyczyć bardziej chłopców niż dziewcząt. Heap i wsp. [34] podkreślają, że zmieniona mineralizacja kości u nastolatków z cukrzycą typu 1 może ograniczać osiągnięcie szczytowej masy kostnej i zwiększyć nasilenie osteoporozy w późniejszym okresie życia. Podobnie obserwacje Valerio i wsp. [35] wskazują na fakt, że słabo wyrównana metabolicznie cukrzyca typu 1 może stanowić dla adolescentów z długotrwającą chorobą ryzyko rozwoju osteopenii w dorosłym życiu. Potwierdzają to wyniki badań Hamiltona i wsp. [36] osób dorosłych z cukrzycą typu 1, które wykazują, że mają oni obniżoną BMD w porównaniu do zdrowych rówieśników.
Powikłania cukrzycy a osteopenia
Obserwacje i badania wskazują na pewną równoległość zaburzeń struktury kostnej w cukrzycy typu 1 i występowania innych tzw. późnych powikłań cukrzycy. Rosadilla i wsp. [37] wykazali, że BMD u pacjentów z cukrzycą typu 1 była podobna u tych, którzy mieli prawidłową i nieprawidłową mikroalbuminurię, zwracając uwagę, że dysfunkcje kostne nie są istotnym problemem cukrzycy typu 1 z krótkim czasem trwania i bez ostrych powikłań. Natomiast Kundsen i wsp. [38] stwierdzili podwyższone stężenie osteoprotegeryny, co prawda u chorych z cukrzycą typu 2 z mikroalbuminurią i makulopatią, co może świadczyć o związku zaburzeń układu OPG/RANKL z występowaniem mikroangiopatii. Wcześniejsze obserwacje Forsta i wsp. [39] wykazały zależność pomiędzy obniżeniem BMD w kości udowej (ale nie w osi szkieletu) i neuropatią cukrzycową. Interesujące obserwacje poczynili Campos i wsp. [40] mierząc BMD (DEXA) i parametry remodelingu kości na początku i po siedmiu latach terapii insulinowej. Stwierdzili, że poprawa kontroli metabolicznej, wzrost BMI i obniżenie parametrów resorpcji kości mogą przyczynić się do stabilizacji masy kostnej w cukrzycy typu 1, ale obecność retinopatii jest krytycznym wskaźnikiem postępującej osteopatii cukrzycowej.
Podsumowanie
Analiza funkcjonowania tkanki kostnej w warunkach fizjologii i patologii związanej z zaburzeniami metabolicznymi w cukrzycy wskazuje na możliwość powstawania u pacjentów z cukrzycą typu 1 wśród późnych powikłań również osteopatii cukrzycowej. Jednak w krótkotrwałej cukrzycy typu 1, ponadto dobrze wyrównanej metabolicznie przy pomocy nowoczesnych metod terapeutycznych, wczesne pojawianie się zmian w strukturze i metabolizmie tkanki kostnej wydaje się mało prawdopodobne. Niemniej należy mieć na uwadze taką możliwość w słabo kontrolowanej, wieloletniej cukrzycy typu 1, powiązanej często z niedoborami wit. D.
Piśmiennictwo
1. Wei J., Hanna T., Suda N., Karsenty G.; Osteocalcin promotes beta-cell proliferation during development and adulthood through Gprc6a; Diabetes 2014:63, 1021-1031
2. Ferron M., Wei J., Yoshizawa T. et al.; Insulin signaling in osteoblasts integrates bone remodeling and energy metabolism; Cell 2010:142, 296-308
3. Fukumoto S., Martin T.J.; Bone as an endocrine organ, Trends Endocrinol; Metab. 2009:20, 230-236
4. Thrailkill K.M., Lumpkin C.K., Burn R.C. et al.; Is insulin an anabolic agent in bone? Dissecting the diabetic bone for clues; Am. J. Physiol. Endocrinol. Metab. 2005:289, 735-745
5. Gandhi A., Beam H.A., O’Connor J.P. et al.; The effects of local insulin delivery on diabetic fracture healing; Bone 2005:37, 482-490
6. Botalin S., McCabe L.R.; Bone loss and increased bone adiposity in spontaneous and pharmagologically induced diabetic mice; Endocrinology 2007:148, 198-205
7. Martin M., McCabe L.R.; Type 1 diabetic bone phenotype is location but not gender dependent; Histochemistry and Cell Biology. 2007:128, 125-133
8. Hofbauer L.C., Schoppet M.; Clinical implications of the osteoprotegerin/RANKL/RANK system for bone and vascular diseases; JAMA 2004:292, 490-495
9. Rogers A., Eastell F.; Circulating osteoprotegerin and receptor activator for nuclear factor (B ligand: clinical utility in metabolic bone disease assesment); J. Clin. Endocrinol. Metab. 2005:90, 6323-6331
10. Kryśkiewicz E., Lorenc R.; Szlak RANKL/RANK/OPG i jego znaczenie w fizjologii i patofizjologii kości; Terapia 2006:3, 52-57
11. Jiang J.X., Siller-Jackson A.J., Burra S.; Roles of gap junctions and hemi-channels in bone cel funktions and in signal transmission of mechanical stress; Front. Biosci. 2007:12, 1450-1452
12. Boyle W.J. et al.; Osteoclast differentiation and activation; Nature 2003:423, 337-342
13. Cough S.C., Simmonds M.J.; The HLA region and autoimmune disease: associations and mechanism of action; Curr. Genomics 2007,8, 453-465
14. Mathieu C., Gyseman C., Giuleti A., Bonillon R.; Vitamin D and diabetes; Diabetologia 2005:48, 1247-1257
15. Szewczyk L., Azab Y., Bury A., Piekarski R.; Próba ochrony komórek beta po zdiagnozowaniu cukrzycy typu 1; Endokrynol. Pol. 2006:5, 35-40
16. Szewczyk L., Piekarski R.; Rola wit. D w cukrzycy typu 1; Endokrynol. Pol. 2008:7, 65-70
17. Thrailkill K.M., Fowlkes J.L.; The role of vitamin D in the metabolic homeostasis of diabetic bone; Clin. Rev. Bone Miner. Metab. 2013:11, 28-37
18. Hamed E.A., Faddan N.H., Elhafeez H.A., Sayed D.; Parathormone-25(OH)vitamin D axis and bone status in children and adolescents with type 1 diabetes mellitus; Pediatr. Diabetes. 2011:12, 536-540
19. Selby P.L.; Osteopenia and diabetes; Diabet. Med. 1988:5, 423-426
20. Lopez-Ibarra P. et al.; Bone mass in type 1 diabetes mellitus; Diabetologia 1992:35, 151-156
21. Tatoń J.; Choroby układu kostno-stawowego powodowane przez cukrzycę [w]: Diabetologia. Red. J. Tatoń, A. Czech; Warszawa PZWL 2001, 308-310
22. Kusumbe A.P., Ramasamy S.H., Adams R.H.; Coupling of angiogenesis and osteogenesis by specyfic vessel subtype in bone; Nature 2014:507, 323-328
23. Ramasamy S.K., Kusumbe A.P., Wang L., Adams R.H.; Endothelial Notch activity promotes angiogenesis and osteogenesis in bone; Nature 2014: 507, 376-380
24. Shin J., Shin Y., Chung C.; Elevated serum osteoprotegerin levels are associated with vascular endothelial dysfunction in type 2 diabetes; Diabetes Care 2006:29, 1664-1666
25. Jackulik P., Payer J.; Osteoporosis, fractures and diabetes; Int. J. Endocrinol. 2014, jun 23 (Epub.)
26. Maddaloni E., Donofrio L., Launa A. et al.; Osteocalcin levels are inversely associated with HbA1c and BMI in adult subjects with long-standing type 1 diabetes; J. Endocrinol. Invest. 2014, maj 24 (Epub.)
27. Saito M., Marumo K.; Bony quality and diabetes; Front. Endocrinol. 2013:4,72-76
28. Abd El Dayem S.M., El-Shehaby A.M., Abd El Gafeir A. et al.; Bone density, body composition and markers of bone remodeling in type 1 diabetic patients; Scand. J. Clin. Lab. Invest. 2011:71, 387-393
29. Maggio A.B., Rizzok R.A., Marchand L.M. et al.; Physical activity increases bone mineral density in chikdren with type 1 diabetes; Med. Sci. Sports Exerrc. 2012:44, 1206-1211
30. Yaturu S.; Diabetes and skeletal health; J. Diabetes 2009:1, 246-254
31. Camurdan M.O., Ciaz P., Bideci A., Demirel F.; Role of hemoglobin A(1c), duration and puberty on mineral density in diabetic children; Pediatr. Int. 2007:49, 645-651
32. Vina S., Bueno L.G., Armanda M. et al.; Bone mineral density in juvenile-onset diabetes mellitus; An. Esp. Pediatr. 2000:52, 507-515
33. Saha M.T., Sievanen H., Salo M.K. et al.; Bone mass and structure in adolescents with type 1 diabetes compared to healthy peers; Osteoporos. Int. 2009:20, 140-146
34. Heap J., Murray M.A., Miller S.C. et al.; Alterations in bone characteristics associated with glicemic control in adolescents with type 1 diabetes mellitus; J. Pediatr. 2004:144, 56-62
35. Valerio G., del Puente A., Esposito-del Puente A. et al.; The lumbar bone mineral density is affected by long-term poor metabolic control in adolescents with type 1 diabetes mellitus; Hormone Res. 2002:58, 266-272
36. Hamilton E.J., Rakic V., Davis W.A. et al.; Prevalance and predictor of osteopenia and osteoporosis in adults with type 1 diabetes; Diabet. Med. 2009:26, 45-52
37. Rosadilla A., Nolla J.M., Montana E. et al.; Bone mineral density in patients with type 1 diabetes mellitus; Joint Bone Spine. 2000:67, 215-218
38. Kundsen S.T., Foss C., Poulsen P.L. et al.; Increased plasma concentrations of osteoprotegerin in type 2 diabetic patients with microvascular complications; Eur. J. Endocrinol. 2003:149, 39-42
39. Forst T., Pfutzner A., Kann P. et al.; Peripheral osteopenia in adult patients with insulin-dependent diabetes mellitus; Diabet. Med. 1995:12, 874-879
40. Campos P., Lopez-Ibarra P.J., Escobar=Jimenez J.; Intensive insulin therapy and bone mineral density in type 1 diabetes mellitus; Osteoporos. Int. 2000:11, 455-459








