Endokrynol. Ped. 13/2014;1(46):61-68
DOI: 10.18544/EP-01.13.01.1478
Zespół częściowej niewrażliwości na androgeny – opis przypadku
1Klinika Pediatrii, Endokrynologii, Diabetologii, Chorób Metabolicznych i Kardiologii Wieku Rozwojowego Pomorskiego Uniwersytetu Medycznego w Szczecinie
2Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi
Słowa kluczowe: zaburzenia różnicowania płciowego, zespół częściowej niewrażliwości na androgeny, gonadektomia, korekcja chirurgiczna narządów płciowych, substytucja hormonalna
Streszczenie
Zespół niewrażliwości na androgeny (AIS, androgen insensitivity syndrome, zespół Morrisa) jest wrodzonym, dziedziczonym w sposób recesywny sprzężony z chromosomem X, zaburzeniem rozwoju płciowego. Przedstawiono przypadek 11-letniej dziewczynki, diagnozowanej z powodu przerostu łechtaczki. Stwierdzono żeńską identyfikację płciową, obecność jąder w kanałach pachwinowych, a w badaniu cytogenetycznym kariotyp 46,XY. Badania hormonalne i obrazowe potwierdziły rozpoznanie zespołu częściowej niewrażliwości na androgeny. Ze względu na podwyższone ryzyko nowotworu złośliwego jąder, a także możliwość postępu objawów wirylizacji chorą zakwalifikowano do zabiegu całkowitego usunięcia gonad. Odroczono chirurgiczną korekcję zewnętrznych narządów płciowych do okresu podojrzewaniowego. Rozpoczęto terapię estrogenową
Wstęp
Zaburzenia rozwoju płci (ZRP) z kariotypem 46,XY według przyjętego w 2006 r. konsensusu amerykańskiego towarzystwa Lawson Wilkins Pediatric Endocrine Society (LWPES) oraz europejskiego European Society for Pediatric Endocrinology (ESPE) można podzielić na trzy podstawowe grupy: 1) nieprawidłowe różnicowanie i/lub rozwój gonad (jąder), 2) zaburzenia biosyntezy oraz 3) aktywności androgenów [1]. Przykładem tej ostatniej grupy jest zespół niewrażliwości na androgeny (ang. androgen insensitivity syndrome, AIS, zespół Morrisa), który dziedziczony jest w sposób recesywny sprzężony z chromosomem X i uwarunkowany mutacją w obrębie genu kodującego receptor androgenowy (ang. androgen receptor, AR). U ludzi gen AR jest zlokalizowany na proksymalnej części ramienia długiego chromosomu X (locus Xq11-12) [2]. Do końca roku 2011 zarejestrowano ponad 800 mutacji AR w bazie Cambridge [3]. Większość z tych mutacji ulokowana jest w domenie wiążącej ligand. AIS najczęściej występuje rodzinnie, ale w ok. 30% przypadków jest to mutacja de novo. Ponieważ mutacja przenoszona jest przez chromosom X, osoby z kariotypem 46,XX nie mają wcale lub mają tylko minimalne objawy niewrażliwości na androgeny, podczas gdy u osób z kariotypem 46,XY mutacja AR wykazuje większą ekspresję. Jednak u części osób z AIS nie stwierdza się mutacji w receptorze AR. Podejrzewa się tutaj mutacje w innych genach odpowiedzialnych za biosyntezę i metabolizm androgenów, polimorfizm genu AR (większa ilość powtórzeń CAG i GGN) oraz mozaicyzm somatyczny AR [4].
Zespół występuje z częstością 1:20000–1:640000 urodzeń żywych męskich noworodków [5, 6] i 1:20000–1:99000 osób z męskim kariotypem [7]. Brak aktywności AR uniemożliwia biologiczne działanie testosteronu i dihydrotestosteronu w okresie płodowym. Z tego powodu nie dochodzi do rozwoju struktur pochodzących z przewodów śródnerczowych Wolffa i nie powstają wewnętrzne męskie narządy płciowe (najądrza, nasieniowody, pęcherzyki nasienne i gruczoł krokowy). Dochodzi natomiast do regresji przewodów przyśródnerczowych Müllera pod wpływem hormonu antymüllerowskiego (ang. antimüllerian hormone, AMH), syntetyzowanego w komórkach Sertoliego jąder, przez co nie rozwijają się żeńskie wewnętrzne narządy płciowe (macica, jajowody, górna część pochwy). Z powodu braku działania androgenów nie rozwijają się także zewnętrzne męskie narządy płciowe z płodowej zatoki moczowo-płciowej.
Z kolei w okresie spodziewanego dojrzewania płciowego z tego samego powodu może wystąpić brak rozwoju wtórnych męskich cech płciowych (owłosienia ciała typu męskiego, mutacji głosu, męskich proporcji ciała).
AIS prezentuje szerokie spektrum cech fenotypowych, począwszy od łagodnych objawów niewrażliwości na androgeny u mężczyzn (ang. mild androgen insensitivity syndrome, MAIS), poprzez fenotyp obojnaczy (częściowy zespół niewrażliwości na androgeny, ang. partial androgen insensitivity syndrome, PAIS) aż do fenotypu kobiecego z prawidłowo wykształconymi zewnętrznymi narządami płciowymi u osób z kariotypem 46,XY (całkowity zespół niewrażliwości na androgeny, ang. complete androgen insensitivity syndrome, CAIS). U części chorych rozpoznanie zaburzenia następuje już w okresie noworodkowym, jednak w większości przypadków dopiero pierwotny brak miesiączki u dziewczynek lub brak pełnego rozwoju męskich cech płciowych u chłopców w okresie dojrzewania rozpoczyna proces diagnostyczny [8,9].
Diagnostyka różnicowa ZRP z kariotypem 46,XY wymaga wykluczenia szeregu zaburzeń steroidogenezy nadnerczowo-gonadalnej, w tym niedoboru białka StAR (ang. steroidogenic acute regulatory protein), niedoboru dehydrogenazy 17beta-hydroksysteroidowej (HSD17B3) i 3beta-hydroksysteroidowej (HSD3B2), niedoboru 17alfa-hydroksylazy (CYP17A1) oraz 11alfa-hydroksylazy (CYP11A1), defektu oksydoreduktazy P450 (POR) oraz deficytu 5alfa-reduktazy (SRD5A2). Jednak pomimo coraz lepszego rozwoju diagnostyki genetycznej nadal
u około 30–40% pacjentów z tej grupy zaburzeń nie udaje się postawić ostatecznego rozpoznania [8,9].
Opis przypadku
Przedstawiamy przypadek 11-letniej dziewczynki, dziecka młodych, zdrowych, niespokrewnionych rodziców, urodzonej z ciąży I, w 40 tygodniu ciąży w stanie dobrym, z masą ciała 3800 g i długością 60 cm. Rozwój psychoruchowy dziecka w okresie niemowlęcym i dziecięcym przebiegał prawidłowo, bez poważniejszych chorób. W 10 roku życia dziewczynka została skierowana do Oddziału Gastroenterologii Dziecięcej z powodu dolegliwości bólowych brzucha oraz nieznacznej niedokrwistości. Wówczas w badaniu przedmiotowym stwierdzono przerost łechtaczki oraz częściowe zrośnięcie warg sromowych. Zmiany te matka zauważyła już około sześciu miesięcy wcześniej.
Przy przyjęciu do Kliniki Pediatrii, Endokrynologii, Diabetologii, Chorób Metabolicznych i Kardiologii Wieku Rozwojowego Pomorskiego Uniwersytetu Medycznego w Szczecinie w badaniu fizykalnym stwierdzono: fenotyp żeński, wysokość 145 cm (25–50 centyl) i masę ciała 37,5 kg (50 centyl), BMI 17,9 kg/m2, stadia pokwitania wg skali Tannera Th I, Pb II, Ax I, trzon łechtaczki długości ok. 3 cm, częściowe zrośnięcie warg sromowych, w obu okolicach pachwinowych owalne twory o wymiarach 1,5 x 1,5 cm. Dziecko wykazywało żeńską identyfikację płciową, co potwierdzono w badaniu psychologicznym.
W wykonanych badaniach obrazowych (ultrasonografia oraz rezonans magnetyczny) w miednicy mniejszej nie uwidoczniono jajników oraz macicy, a jedynie szczątkową pochwę. W obu kanałach pachwinowych stwierdzono obecność niezstąpionych jąder z najądrzami. Badanie genetyczne ujawniło prawidłowy męski kariotyp 46,XY. Przeprowadzono diagnostykę różnicową przyczyn zaburzeń różnicowania płci z kariotypem 46, XY.
W profilu hormonalnym stwierdzono stężenia testosteronu w granicach normy dla dojrzałych mężczyzn (4,6 ng/ml, N: 2,8–8,0 ng/ml), LH na górnej granicy normy dla mężczyzn (8,5 mIU/ml, N:1,7–8,6 mIU/ml), a także podwyższone stężenie FSH (26,4 mIU/ml, N: 1,5-12,4mIU/ml), stężenia estradiou wynosiły 8,19 pg/ml (N: 5,0-20,0 pg/ml). Odpowiedź przysadki w teście stymulacyjnym z LH-RH była prawidłowa (tabela I). Stwierdzono także nieco podwyższone stężenie 17-hydroksyprogesteronu (1,75 ng/ml, N: 0,2-1,3 ng/ml), prawidłowe stężenie androstendionu (1,0 ng/ml, N: 0,3-3,5 ng/ml) i obniżone stężenie dehydroepiandrostendionu (22,9 ug/dl, N: 35-430 ug/dl). Odpowiedź jąder w teście z ludzką gonadotropiną kosmówkową (hCG) (Pregnyl, jednorazowo 1500 j./m2 pow. ciała, i.m.) była także prawidłowa: godz. 0 – 2,99 ng/ml, godz. 48 – 7,17 ng/ml. Profil steroidowy w dobowej zbiórce moczu pozwolił na wykluczenie zaburzeń steroidogenezy oraz niedoboru 5alfa-reduktazy. Nie stwierdzono zaburzeń jonowych ani podwyższonych stężeń markerów nowotworowych (β-hCG, alfa-fetoproteiny, CEA). Wiek kostny pacjentki oceniono na 10 lat.
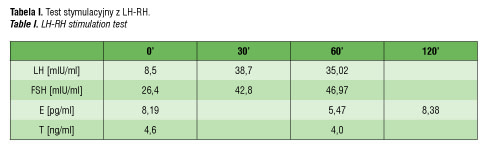
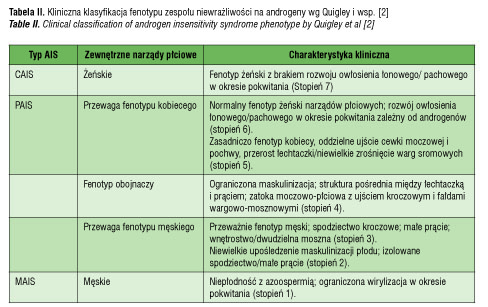
Na podstawie całości obrazu klinicznego wysunięto podejrzenie zespołu częściowej niewrażliwości na androgeny (stopień 5 według skali Quigley’a) (tabela II).
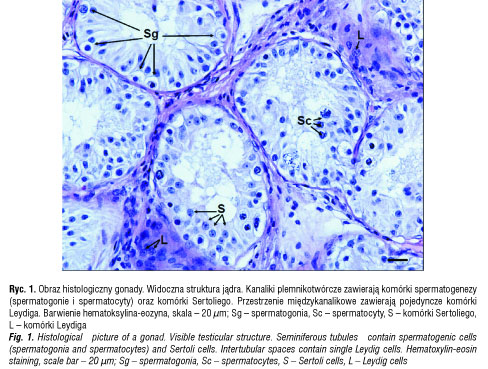
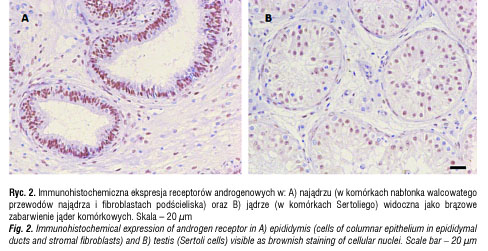
Z uwagi na żeńską identyfikację płciową pacjentki oraz wysokie ryzyko rozwoju złośliwego nowotworu jąder z komórek płciowych (ang. germ cell tumour) w Klinice Chirurgii i Urologii Dziecięcej Instytutu Centrum Zdrowia Matki Polki w Łodzi przeprowadzono obustronną gonadektomię. W badaniu histopatologicznym obraz gonad odpowiadał przedpokwitaniowym jądrom ze zmniejszoną liczbą komórek płciowych (ryc. 1). Nie stwierdzono zmian nowotworowych. Reakcja immunohistochemiczna z przeciwciałami poliklonalnymi przeciwko AR (Santa Cruz Biotechnology, USA) wykazała silną ekspresję AR w komórkach nabłonka walcowatego przewodów najądrza oraz fibroblastach podścieliska oraz słabą ekspresję w komórkach Sertoliego w kanalikach plemnikotwórczych, ale jej brak w komórkach Leydiga gruczołu śródmiąższowego jądra (ryc. 2).
Po zabiegu operacyjnym rozpoczęto substytucję estradiolem (system transdermalny) we wzrastających dawkach od 0,0125 do 0,025 mg/dobę, uzyskując po roku postęp dojrzewania płciowego (Th III, Pb III, Ax II) i następujące stężenia hormonów: FSH – 1,41 mIU/ml, LH – 0,3 mIU/ml, estradiol – 49,5 pg/ml, testosteron – 0,03 ng/ml. Pacjentkę objęto opieką psychologiczną. Decyzję o przeprowadzeniu operacji korekcyjnej zewnętrznych narządów płciowych za zgodą pacjentki i jej rodziców odroczono do czasu uzyskania przez pacjentkę dojrzałości płciowej i możliwości podjęcia świadomej decyzji co do dalszego postępowania.
Dyskusja
U fenotypowych dziewczynek AIS jest zwykle diagnozowany w okresie dojrzewania z powodu pierwotnego braku miesiączki. Zdecydowanie rzadziej diagnostykę rozpoczyna się w okresie noworodkowym, a nawet prenatalnie z powodu niezgodności męskiego kariotypu ocenianego podczas amniocentezy z żeńskimi narządami płciowymi stwierdzanymi w badaniu ultrasonograficznym.
U opisywanej dziewczynki po urodzeniu i we wczesnym dzieciństwie nie obserwowano odchyleń od normy w zakresie budowy narządów płciowych. Wirylizację stwierdzono w 11 roku życia przy okazji diagnostyki zaburzeń ze strony innych układów, chociaż matka zauważyła powiększenie łechtaczki u dziecka około pół roku wcześniej. Zjawisko to było objawem reakcji tkanek obwodowych na zwiększające się stężenia androgenów wytwarzanych przez nadnercza i jądra w początkowym okresie dojrzewania. Prawidłowy męski kariotyp, obecność jąder, wysokie stężenia testosteronu i LH , jak również brak macicy z obecnością szczątkowej pochwy pozwoliły na rozpoznanie AIS. Jednak ze względu na reakcję niektórych tkanek obwodowych na androgeny (powiększenie łechtaczki, rozwój owłosienia pachowego i łonowego) oraz immunohistochemiczną ekspresję AR w obrębie najądrzy, słabszą w obrębie kanalików jądra i jej brak w komórkach Leydiga, ostatecznie rozpoznano PAIS. Wykluczono jako przyczynę bloki enzymatyczne w steroidogenezie nadnerczowej i jądrowej. Podwyższone stężenie FSH mogło nasuwać podejrzenie dysgenezji gonad, ale w badaniu histopatologicznym nie stwierdzono cech dysgenezji jąder, a ponadto brak rozwoju przewodów Müllera oraz wysokie stężenia testosteronu i dobra odpowiedź w teście z hCG wykluczyły to rozpoznanie. Opisywano już podwyższone stężenie FSH u pacjentek z AIS w innych publikacjach [10].
Badanie psychologiczne potwierdziło żeńską identyfikację płciową pacjentki i ukierunkowało dalsze postępowanie terapeutyczne w kierunku żeńskim. Postępowaniem z wyboru u pacjentek z AIS jest usunięcie gonad ze względu na zwiększone ryzyko zmian nowotworowych w jądrach [11,12]. Najczęściej występują w tych przypadkach nowotwory pochodzenia zarodkowego, wywodzące się z pierwotnych płodowych komórek płciowych, takie jak gonadoblastoma, raki zarodkowe, kosmówczaki, potworniaki i nasieniaki. Nowotwory te w przypadku PAIS występują z częstością 10–25%, podczas gdy w CAIS z częstością 0,8–2% [13,14]. Przy AIS jest także większe ryzyko nowotworu wywodzącego się z komórek Sertoliego (sertolioma) – ok. 20% [15]. Nowotwory te są zwykle łagodne, ale opisywano także przypadki gruczolakoraków. Ponieważ ryzyko zmian nowotworowych zwiększa się wraz z wiekiem, przy CAIS gonadektomia jest polecana przed lub wkrótce po dojrzewaniu płciowym [3]. Ciągle jednak pozostaje sprawą dyskusyjną, czy jednak gonad nie pozostawiać, ponieważ są źródłem steroidów płciowych. Jądra wydzielają testosteron, który w tkankach obwodowych ulega konwersji do estradiolu przy udziale enzymu aromatazy. Dzięki temu stężenie estrogenów jest na tyle wysokie, że zwykle zapewnia rozwój wtórnych żeńskich cech płciowych i nie jest niezbędna substytucja estrogenowa. W przypadku odstąpienia od gonadektomii obowiązuje co roku kontrola pozostawionych gonad (markery nowotworowe, badanie ultrasonograficzne jamy brzusznej). Przy PAIS gonadektomia jest wskazana przed rozpoczęciem dojrzewania płciowego nie tylko ze względu na profilaktykę nowotworową, ale także ze względu na możliwość pojawienia się męskich cech płciowych u osób z fenotypem żeńskim i z żeńską identyfikacją płciową oraz z częściowo zachowaną aktywnością AR [3,16].
Zabieg usunięcia gonad u opisywanej dziewczynki przeprowadzono metodą otwartą, ale opisywane są tego typu zabiegi przeprowadzane metodą laparoskopową [17].
Zgodnie z konsensusem ESPE/LWPES z roku 2006 rekomenduje się przeprowadzanie chirurgicznej korekcji zewnętrznych narządów płciowych dopiero po zakończeniu dojrzewania, a nawet po osiągnięciu pełnoletności, co umożliwia świadomy udział chorego w podejmowaniu decyzji co do zabiegu [18]. Zabiegi te polegają na zmniejszeniu łechtaczki, plastyce warg sromowych oraz powiększaniu długości i szerokości pochwy [19]. Zabiegi zmniejszania łechtaczki wiążące się z ryzykiem uszkodzenia pęczków nerwowo-naczyniowych powinny być poprzedzone świadomą decyzją pacjentki, podjętą po osiągnięciu dojrzałości psychoseksualnej, i przeprowadzone w ośrodku posiadającym doświadczenie w tego typu operacjach [18,20–23]. Nie zaleca się przeprowadzania zabiegów poszerzania pochwy w okresie przeddojrzewaniowym ze względu na dużą ilość powikłań i konieczność późniejszej reoperacji, a także na brak motywacji ze strony pacjentki do tego typu postępowania [3].
Podkreśla się również, że niemal całkowitemu ograniczeniu powinno ulec fotografowanie zewnętrznych narządów płciowych. Jest ono akceptowane tylko w znieczuleniu ogólnym podczas zabiegu chirurgicznego jako dokumentacja chirurgiczna [9,16,18]. Kwestionuje się też potrzebę publikacji i prezentacji zdjęć narządów płciowych podczas konferencji medycznych, głównie ze względu na uraz psychiczny towarzyszący pozyskiwaniu pisemnej zgody na publikację tych zdjęć.
Konsekwencją wykonania obustronnej gonadektomii jest rozwój hipogonadyzmu hipergonadotropowego. U dziewcząt z AIS konieczne jest zalecenie substytucji estrogenowej w celu indukcji objawów dojrzewania płciowego, uzyskania optymalnej gęstości mineralnej kości oraz zapewnienia prawidłowego rozwoju psychoseksualnego i dobrego samopoczucia [3,24]. U kobiet bez macicy nie jest konieczne podawanie progesteronu. U opisywanej dziewczynki rozpoczęto substytucję estrogenową wkrótce po gonadektomii w 11 roku życia, uzyskując po roku początkowe objawy dojrzewania płciowego. Substytucja hormonalna musi być kontynuowana przynajmniej do 50 roku życia. Należy pamiętać o działaniach ubocznych tych preparatów, m.in. o ryzyku choroby zakrzepowo-zatorowej, i kontrolować stan zdrowia pacjentki.
Proces diagnostyczno-leczniczy u osób z zaburzeniami rozwoju płci powinien uwzględniać stałą opiekę psychologiczną nad chorym i jego rodziną [25]. W trakcie opieki nad opisywaną dziewczynką przeprowadzono z chorą i jej rodzicami kilkakrotnie rozmowy na temat przyczyn i patofizjologii schorzenia, a także diagnostyki i metod terapeutycznych. Wspólnie podjęto decyzję o gonadektomii, substytucji hormonalnej i odroczeniu operacji kosmetycznej zewnętrznych narządów płciowych.
Piśmiennictwo
1. Hughes I.A., Houk C., Ahmed S.F. et al.; Lawson Wilkins Pediatric Endocrine Society/European Society for Pediatric Endocrinology Consensus Group. Consensus statement on management of intersex disorders; J. Pediat. Urol. 2006:2(3), 148-162
2. Galani A., Kitsiou-Tzeli S., Sofokleous Ch. et al.; Androgen insensitivity syndrome: clinical features and molecular defects; Hormones 2008:7, 217-229
3. Hughes I.A., Davies J.D., Bunch T.I. et al.; Androgen insensitivity syndrome; Lancet 2012:20, 1419-1428
4. Jääskeläinen J.; Molecular biology of androgen insensitivity; Mol. Cell Endocrinol. 2012: 16, 4-12
5. Starzyk J., Górska A., Januś D.; Zespół całkowitej niewrażliwości na androgeny u 16-letniej fenotypowej dziewczynki; Endokrynol. Diabetol. Chor. Przem. Mat. Wieku Rozw. 2005:11, 47-49
6. Magnuszewska H., Birkholz D., Deli D. et al.; Trudności diagnostyczne i terapeutyczne u 13-letniej dziewczynki z zaburzeniami rozwoju płci z kariotypem 46,XY – opis przypadku; Endokrynol. Ped. 2009:3, 55-60
7. Oakes M.B., Eyvazzadeh A.D., Quint E.et al.; Complete androgen insensitivity syndrome – a review; J. Pediatr. Adolesc. Gynecol 2008:21, 305-310
8. Quigley C., De Bellis A., Marschke K. et al.; Androgen receptor defects: historical, clinical, and molecular perspectives; Endocr. Rev. 1995:16, 271-321
9. Kucharska A., Szarras-Czapnik M.; Zaburzenia rozwoju płci – aktualne wytyczne dotyczące klasyfikacji diagnostyki i postępowania; Endokrynol. Ped. 2007:4, 51-60
10. Magnuszewska H, Birkholz D, Deli D. et al.; Trudności diagnostyczne I terapeutyczne u 13-letniej dziewczynki z zaburzeniami rozwoju płci z kariotypem 46,XY – opis przypadku; Endokrynol. Ped. 2009:3, 55-60
11. Hughes I.A., Houk C., Ahmed S.F. et al.; Consensus statement on management of intersex disorders; J. Ped. Urol. 2006:2, 148-162
12. Słowikowska-Hilczer J., Gumińska A., Kula K.; Pathogenesis and active prevention of testicular germ cell neoplasia; J. Reprod. Endocrinol. 2007: 4, 313-321
13. Cools M., Looijenga L.H.; Tumor risk and clinical follow-up in patients with disorders of sex development; Pediatr. Endocrinol. Rev. 2011:9, 519-524
14. Pleskacova J., Hersmus R., Oosterhuis J.W. et al.; Tumor risk in disorders of sex development; Sex Dev. 2010:4(4-5), 259-69
15. Siminas S, Kokai G, Kenny S.E.; Complete androgen insensitivity syndrome associated with bilateral Sertoli cell adenomas and paratesticular leiomyomas: Case report and review of the literature; J. Ped. Urol. 2013: 9, e31-e34
16. Bajszczak K., Szarras-Czapnik M., Oszukowska E. et al.; Kliniczne i psychologiczne konsekwencje odroczenia operacji obojnaczych zewnętrznych narządów płciowych do okresu dojrzałości u pacjentki z częściową niewrażliwością na androgeny; Endokrynol. Ped. 2013: 2, 69-80
17. Jędrzejczak P., Serdyńska-Szuster M., Wachowiak-Ochmańska K. et al.; Laparoskopowa gonadektomia u pacjentki z kompletnym zespołem niewrażliwości na androgeny – opis przypadku; Ginekol. Pol. 2010:81, 457-460
18. Hughes IA., Nihoul Fekete C., Thomas B. et al.; Consequences of the ESPE/LWPES guidelines for diagnosis and treatment of disorder of sex development; Best Pract. Res. Clin. Endocrinol. Metab. 2007:21, 351-365
19. Kula K., Słowikowska-Hilczer J., Oszukowska E.; Korekcja obojnaczych narządów płciowych; Przegl. Urol. 2001:3, 43-47
20. Jurgensen M., Hiort O., Holterhus P.M. et al.; Gender role behaviour in children with XY karyotype and disorders of sex development; Hormones and Behaviour 2007: 51, 443-453
21. Kula K., Słowikowska-Hilczer J.; Badania kliniczne i doświadczalne nad różnicowaniem płci mózgu; Endokrynol. Pol. 2003:4, 472-479
22. Brinkmann L., Schuetzmann K., Richter-Appelt H.; Gender assignment and medical history of individuals with different forms of intersexuality: evaluation of medical records and the patients‘ perspective; J. Sex. Med. 2007:4, 964-980
23. Ziora K., Paradysz A., Oświęcimska J. et al.; Odległe wyniki chirurgicznej korekcji zewnętrznych narządów płciowych; Endokrynol. Ped. 2005:4, 39-45
24. Warne G.L., Grover S., Zajac J.D.; Hormonal therapies for individuals with intersex conditions: protocol for use; Treat. Endocrinol. 2005:4, 19-29
25. Kleinemeier E., Jurgensen M., Lux A. et al.; Psychological adjustment and sexual development of adolescents with disorders of sex development; J. Adol. Health 2010:47, 463–471








