Endokrynol. Ped. 12/2013;4(45):37-44
DOI: 10.18544/EP-01.12.04.1466
Stan metabolizmu kostnego u niemowląt z rozmiękaniem potylicy w zależności od stężenia 25(OH)D we krwi
Klinika Patologii Noworodków i Niemowląt, Uniwersytet Medyczny w Lublinie
Słowa kluczowe: witamina D, 25(OH)D, markery kostne, niemowlęta
Streszczenie
Wstęp. Zaburzenia gospodarki wapniowo-fosforanowej i metabolizmu kostnego, obserwowane w okresie niemowlęcym, prowadzą nie tylko do jawnych objawów klinicznych, ale wywołując trwałe zmiany w tkance kostnej, mogą w przyszłości predysponować do rozwoju osteoporozy. Celem pracy była ocena wpływu zasobów ustrojowych witaminy D na metabolizm i mineralizację układu kostnego u niemowląt z rozmiękaniem potylicy. Materiał i metody. Badanie przeprowadzono u 55 niemowląt w wieku 2-6 mies. Oznaczono stężenie wapnia, fosforu, parathormonu, 25(OH)D i 1,25(OH)2D w surowicy krwi oraz wskaźnik wapniowo-kreatyninowy w moczu. Badanych pacjentów podzielono na 3 grupy w zależności od stężenia 25(OH)D w surowicy: grupa I – 25(OH)D <30ng/ml, grupa II – 25(OH)D 31-80ng/ml, grupa III – 25(OH)D >80ng/ml. Stężenie markerów mineralizacji i obrotu kostnego, takich jak: osteoprotegryna, sRANKL, C-końcowy telopeptyd łańcucha alfa kolagenu typu I (CrossLaps) i C-końcowy propeptyd prokolagenu typu I (CICP) w surowicy, oznaczono metodą immunoenzymatyczną. Wyniki badań poddano analizie statystycznej z wykorzystaniem programu STATISTICA 6.0, przyjmując wartości istotne statystycznie dla p<0,05. Wyniki. Nie stwierdzono statystycznie istotnych różnic w stężeniu markerów obrotu kostnego pomiędzy badanymi grupami niemowląt, chociaż stężenia osteoprotegryny, sRANKL, CrossLaps i CICP były wyższe u niemowląt z grupy II. Wykazano natomiast statystycznie istotne różnice w stężeniu wapnia, 1,25(OH)2D i parathormonu oraz w wartościach wskaźnika wapniowo-kreatyninowego w badanych grupach. Wnioski. Izolowane objawy kliniczne ze strony układu kostnego w okresie niemowlęcym nie są miarodajnym wykładnikiem stanu zaopatrzenia organizmu w witaminę D i stanu metabolizmu kostnego. Rozmiękanie potylicy może być izolowanym objawem obserwowanym u dzieci z różnymi stężeniami 25(OH)D we krwi
Wstęp
Okres niemowlęcy charakteryzuje się szybkim tempem rozwoju fizycznego i dynamicznym rozwojem układu kostnego. Utrzymanie prawidłowego stężenia wapnia, fosforu, witaminy D w tym okresie życia jest niezbędne dla pełnej realizacji programu genetycznego organizmu w celu osiągnięcia optymalnej mineralizacji układu kostnego i uzyskania szczytowej masy kostnej [1]. Wszelkie zaburzenia gospodarki wapniowo-fosforanowej i metabolizmu kostnego obserwowane w okresie wzmożonego obrotu kostnego skutkują nie tylko określonymi objawami klinicznymi, ale wywołują trwałe zmiany w strukturze tkanki kostnej, predysponując do rozwoju osteoporozy w wieku późniejszym [2].
Jakość tkanki kostnej zależy od prawidłowych proporcji między procesami kościotworzenia i resorpcji oraz mineralizacji. W okresie rozwoju układu kostnego, który trwa do czasu osiągnięcia szczytowej masy kostnej, procesy kościotworzenia przeważają nad resorpcją. Skutkuje to wzrostem kości na długość i grubość oraz zwiększeniem masy kośćca (tzw. modelling). Po osiągnięciu szczytowej masy kostnej w wieku 25–35 lat zaczyna się okres inwolucji z przewagą procesów resorpcji. Natomiast trwająca przez całe życie przebudowa kości (tzw. remodelling) polega na resorpcji starej kości przez osteoklasty i tworzeniu w jej miejsce nowej kości, dzięki czemu możliwe jest zachowanie w sposób ciągły prawidłowej funkcji kości [3, 4]. Dynamika procesów metabolizmu kostnego zależy od etapu ontogenezy. Największa intensywność obrotu kostnego występuje w okresie przyspieszonego rozwoju. Należy podkreślić, że wielkość osiągniętej masy kostnej ma decydujące znaczenie dla odporności mechanicznej kości i wiąże się z ryzykiem osteoporozy [3, 5].
Oceny obrotu kostnego można dokonać za pomocą oznaczenia stężenia markerów metabolizmu kostnego we krwi lub w moczu. Za markery kościotworzenia uważa się m.in. N-końcowy propeptyd prokolagenu typu I (PINP) i C-końcowy pro peptyd prokolagenu typu I (CICP) – oba związane z syntezą kolagenu typu I. Z kolei markerami resorpcji kostnej są C-końcowy telopeptyd kolagenu typu I (CrossLaps) oznaczany w surowicy krwi oraz N-końcowy telopeptyd kolagenu typu I (NTX) w moczu [5,6]. W ocenie gospodarki wapniowo-fosforanowej oprócz składników mineralnych istotną rolę odgrywają 25(OH)D, parathormon, kalcytonina jak również cytokiny biorące udział w metabolizmie kostnym, tj. osteoprotegryna (OPG) i ligand aktywatora receptora jądrowego czynnika kappa B (z ang. Receptor Activator for Nuclear Factor ĸ B Ligand – sRANKL) [7].
Jednym z ważniejszych czynników odpowiedzialnych za prawidłowy rozwój i mineralizację kości jest witamina D. Syntetyzowana w skórze
z 7-dehydrocholesterolu lub dostarczana z pokarmem jako cholekalcyferol jest następnie przekształcana (na drodze hydroksylacji grup węglowych) w wątrobie i w nerkach do aktywnego metabolitu witaminy D 1,25(OH)2D, który po połączeniu ze swoistym receptorem steroidowym (VDR, vitamin D receptor) modyfikuje transkrypcję genów i w ten sposób reguluje zachodzące w organizmie procesy metaboliczne. Receptory swoiste dla witaminy D są obecne w wielu tkankach, m.in. jelicie, nerkach czy przytarczycach. Znana od dawna klasyczna rola witaminy D polega na bezpośrednim udziale w utrzymaniu homeostazy wapniowo-fosforanowej organizmu. Z drugiej strony 1,25(OH)2D drogą autokrynną, parakrynną i intrakrynną oddziałuje bezpośrednio na komórki tkanki kostnej. Do ekspresji 25hydroksywitamino-1α-hydroksylazy (CYP27B1) i VDR dochodzi zarówno na osteoblastach, jak i chondrocytach. Poprzez zmianę ekspresji VDR na komórkach osteoblastów 1,25(OH)2D reguluje procesy ich różnicowania i dojrzewania. Zwiększona ilość VDR na dojrzałych osteoblastach zwiększa ich aktywność, stymuluje syntezę kolagenu I, fosfatazy alkalicznej i osteokalcyny. Z kolei obecność receptorów witaminy D na chondrocytach skutkuje wzrostem ekspresji RANKL i VEGF (ang. Vascular Endothelial Growth Factor – czynnik wzrostu śródbłonka naczyniowego) oraz pobudzeniem osteoklastogenezy. Najnowsze badania sugerują również, że szlak 1,25(OH)2D w chondrocytach reguluje jednocześnie transkrypcję nieznanego do tej pory czynnika, który prowadząc do wzrostu FGR23 (ang. fibroblast growth factor 23 – czynnik wzrostu fibroblastów) w chondrocytach wpływa na gospodarkę fosforanową [8, 9].
W praktyce klinicznej zasoby ustrojowe witaminy D są oceniane na postawie oznaczania stężenia 25(OH)D. „Złotym standardem” w oznaczaniu 25(OH)D w surowicy są pomiary bezpośrednie, tj. metodą wysokosprawnej chromatografii cieczowej oraz spektometrii masowej sprzężonej z chromatografią cieczową. Oznaczanie metodami pośrednimi, w tym radioimmunologicznymi, które stosowano w niniejszym opracowaniu, obarczone jest możliwym błędem wynikającym z faktu, że w całej puli osoczowej 25(OH)D pewien procent mogą stanowić diastereoizomery, nieaktywne biologicznie.
W przeciwieństwie do 1,25(OH)2D, aktywnej biologicznie formy witaminy D, 25(OH)D ma dłuższy okres półtrwania (2-3 tyg. vs 4-6 godz.).
Biorąc pod uwagę kluczową rolę witaminy D w procesie rozwoju kośćca, celem naszej pracy była ocena metabolizmu kostnego oraz homeostazy wapniowo-fosforanowej w zależności od stanu zaopatrzenia organizmu w witaminę D.
Materiał i metody
Do badania włączono 55 niemowląt, w wieku 2–6 mies., u których w badaniu klinicznym stwierdzono rozmiękanie potylicy. Badane dzieci były hospitalizowane w Klinice Patologii Noworodków i Niemowląt UM w Lublinie z powodu ostrego zakażenia układu oddechowego lub zakażenia układu moczowego. U żadnego z niemowląt nie zdiagnozowano wad wrodzonych, zaburzeń endokrynologicznych, chorób metabolicznych i innych przewlekłych problemów zdrowotnych. Wśród badanych były dzieci karmione naturalnie i sztucznie. Wszystkie otrzymywały witaminę D w dawkach profilaktycznych. Protokół badania został zaakceptowany przez Komisję Bioetyczną działającą przy Uniwersytecie Medycznym w Lublinie.
W trakcie hospitalizacji dzieci miały wykonywane badania dodatkowe. W pracy wykorzystano oznaczenia stężenia wapnia, fosforu, parathormonu, 1,25(OH)2D i 25(OH)D w surowicy krwi oraz wskaźnika wapniowo-kreatyninowego w moczu. Od każdego dziecka pobrano również próbkę krwi, którą po odwirowaniu zamrożono i zabezpieczono do czasu oznaczenia wybranych markerów obrotu kostnego. Po zebraniu całości materiału dokonano pomiarów stężenia osteoprotegryny (OPG), sRANKL, C-końcowego teopeptydu kolagenu typu I (Cross Laps) i C-końcowego propeptydu prokolagenu typu I (CICP) z wykorzystaniem dostępnych na rynku zestawów ELISA. Otrzymane wyniki przeanalizowano w obrębie całej badanej populacji (n=55) jak również w obrębie trzech grup, które wyodrębniono biorąc pod uwagę stężenie 25(OH)D jako najbardziej optymalny wskaźnik zaopatrzenia organizmu w witaminę D: • grupa I – n=12 – niemowlęta ze stężeniem 25(OH)D w surowicy krwi poniżej 30ng/ml • grupa II – n=29 – niemowlęta ze stężeniem 25(OH)D 31-80ng/ml • grupa III – n=14 – niemowlęta, u których stężenie 25(OH)D przekraczał 80ng/ml.
Kryteria podziału grup ustalono uwzględniając obowiązujące w czasie przeprowadzania badania normy optymalnego stężenia witaminy D w organizmie (na podstawie aktualnych wówczas doniesień naukowych przyjęto za optymalny dla zapewnienia prawidłowych przemian metabolicznych poziom witaminy D powyżej 30ng/ml, natomiast wartości 25(OH)D 80–100ng/ml uznawane wówczas były za toksyczne) [10–12].
Dane poddano analizie statystycznej z wykorzystaniem programu komputerowego Statistica 6.0 PL. Normalność rozkładu cech mierzalnych ocenianych w badaniu sprawdzono za pomocą testu Shapiro-Wilka. Istotność różnic między grupami wyliczono za pomocą testu ANOVA i potwierdzono testem post-hoc Tukeya. Do oceny związków zależności pomiędzy analizowanymi parametrami użyto testów korelacji Pearsona i Spearmana. P<0,05 przyjęto za istotny statystycznie.
Wyniki
U żadnego z badanych dzieci stężenie 25(OH)D nie wskazywało na niedobór witaminy D. W grupie niemowląt z najniższymi wartościami 25(OH)D (n=12) średnie stężenie 25(OH)D wynosiło 20,87 ng/ml. Większość badanych niemowląt (n=29) osiągnęła stężenie 25(OH)D w granicach pomiędzy 31–80 ng/ml, ze średnią wartością 51,86 ng/ml. U 14 niemowląt stężenie 25(OH)D było wysokie, tj. >80 ng/ml. Średnie stężenia oznaczanych markerów obrotu kostnego i mineralizacji u badanych niemowląt przedstawia tabela I.
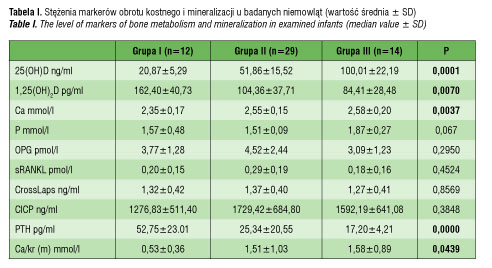
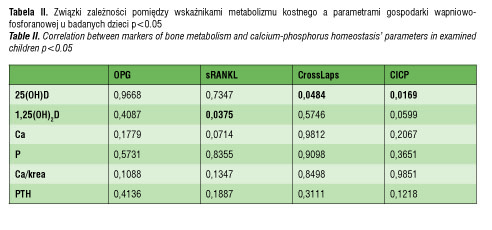
Stwierdzono istotne statycznie różnice w stężeniu wapnia, 1,25(OH)2D i PTH w surowicy krwi i w wartości wskaźnika wapniowo-kreatyninowego w moczu pomiędzy badanymi grupami niemowląt. W grupie I średnie stężenie wapnia w surowicy i wartość wskaźnika wapniowo-fosforanowego były najniższe, podczas gdy stężenie PTH i 1,25(OH)2D najwyższe w tej grupie niemowląt. W przypadku badanych markerów obrotu kostnego (OPG, sRANKL, CrossLaps, CICP) stwierdzone różnice w stężeniach w zależności od 25(OH)D nie były istotne statystycznie, aczkolwiek wyraźnie wyższe wartości odnotowano w grupie dzieci z prawidłowym stężeniem witaminy D. Potwierdzono istotne statystycznie korelacje pomiędzy 1,25(OH)2D a sRANKL i wskaźnikiem wapniowo-fosforanowym jak również pomiędzy 25(OH)D a stężeniem CrossLaps i CICP (tabela II).
Dyskusja
Przeprowadzone badanie było próbą oceny metabolizmu kostnego kośćca i homeostazy wapniowo-fosforanowej w zależności od stanu zaopatrzenia organizmu w witaminę D u niemowląt z rozmiękaniem potylicy.
Praktyka kliniczna wskazuje, że izolowane objawy kostne u niemowląt, tj. rozmiękanie kości czaszki, duże wymiary i miękkie brzegi ciemiączka przedniego czy spłaszczenie potylicy nierzadko są nadal interpretowane jako objawy patognonomiczne krzywicy z niedoboru witaminy D. Wśród badanych niemowląt u żadnego nie stwierdzono jawnego niedoboru witaminy D równoznacznego z rozpoznaniem krzywicy niedoborowej. Nawet w grupie niemowląt z najniższymi zasobami ustrojowymi witaminy D średnie stężenie 25(OH)D wynosiło 20,87±5,29 ng/ml, co według najnowszych zaleceń, w tym Amerykańskiej Akademii Pediatrii, jest poziomem akceptowalnym, wystarczającym [13]. Warto tutaj nadmienić, że ustalenie zakresu norm dla witaminy D w organizmie jest nadal sprawą dyskusyjną. Nie tak dawne badania przeprowadzone wśród dorosłych jak i nieliczne u dzieci sugerowały, że korzystne efekty kostne i pozakostne witaminy D są obserwowane przy stężeniach 25(OH)D powyżej 32ng/ml [10–12]. Bezspornie stężenie 25(OH)D w organizmie poniżej 10–11 ng/ml jest uznawane jako hipowitaminoza D. Z drugiej strony poziom witaminy D powyżej 80–100 ng/ml wskazuje na hiperwitaminozę D i może dawać objawy hiperkalcemii i hiperkalciurii [14].
Zgodnie z najnowszymi rekomendacjami Amerykańskiej Akademii Pediatrii i Polskich Ekspertów w okresie niemowlęcym zalecana jest podaż witaminy D3 w dawce 400 IU/dobę od pierwszej doby życia. Wyniki naszego badania również podkreślają olbrzymie znaczenie profilaktyki krzywicy u niemowląt. U żadnego z niemowląt nie stwierdzono niedoboru witaminy D. Warto tu również przytoczyć wyniki badania przeprowadzonego przez Czech-Kowalską i wsp. wśród donoszonych noworodków, które wykazało że ciężkie niedobory witaminy D mogą dotyczyć nawet 63% zdrowych, donoszonych noworodków bez jawnych objawów klinicznych [15].
Powszechnie wiadomo, że niedobór witaminy D w okresie rozwojowym prowadzi do rozwoju krzywicy w kościach rosnących, podczas gdy po zakończeniu wzrostu kości jest on równoznaczny z osteomalacją. Kliniczne objawy krzywicy dotyczą kości długich i przede wszystkim manifestują się jako guzowate poszerzenia części dystalnych kości długich i połączeń chrzęstno-kostnych widoczne jako bransolety krzywicze, różaniec krzywiczy, szpotawość kolan, deformacje klatki piersiowej. Badanie czaszki może również ujawniać objawy słabej mineralizacji, takie jak rozmiękanie kości potylicy (tzw. craniotabes), poszerzone szwy czaszkowe i ciemiączka, spłaszczenie boczne czaszki [16].
W naszym badaniu podstawowym kryterium włączenia dziecka do badania była obecność objawów kostnych sugerujących krzywicę, w tym rozmiękanie potylicy (craniotabes). W latach trzydziestych XX w. stwierdzenie wyżej wymienionych objawów u niemowlęcia traktowane było jednoznacznie jako objaw krzywicy [17]. W kolejnych latach coraz częściej traktowano rozmiękanie potylicy u niemowląt jako zjawisko fizjologiczne niewymagające leczenia, obserwowane u nie więcej niż 30% noworodków i zwykle ograniczone do 2–3 mies. życia [18]. Począwszy od lat osiemdziesiątych XX wieku objawy te traktowane są jednak jako wynik zaburzeń gospodarki wapniowo-fosforanowej występujących w przebiegu wielu chorób. Rozmiękanie potylicy najczęściej jest skutkiem niedoboru witaminy D we wczesnych okresach życia i – na co wskazują najnowsze badania – również w okresie wewnątrzmacicznym. W badaniu przeprowadzonym w latach 2006–2007, obejmującym 1120 noworodków, Yorifuji i wsp. (2008) wykazali obecność rozmiękania potylicy po urodzeniu u 22% noworodków, które wewnątrzmacicznie narażone były na niedobór witaminy D. Co więcej, u 37,3% tych noworodków stężenie 25(OH)D był poniżej 10 ng/ml, co przemawiało za ciężką hipowitaminozą D [19]. Z kolei w badaniu noworodków przeprowadzonym w Polsce przez Czech-Kowalską J. i wsp., mimo że skrajnie niskie stężenie witaminy D stwierdzono u 63% noworodków, nie opisywano rozmiękania potylicy, co tłumaczono prawidłowym stężeniem wapnia u płodu, osiąganym dzięki stałemu transportowi tego pierwiastka przez łożysko [15]. W naszym badaniu rozmiękanie potylicy obserwowane było u niemowląt, pomimo że oznaczone stężenie 25(OH)D było u wszystkich dzieci prawidłowe. Fakt ten dowodzi raz jeszcze, że nieprawidłowe objawy w układzie kostnym u niemowląt nie powinny być pochopnie kwalifikowane jako objawy krzywicy i wymagają szczegółowej diagnostyki gospodarki wapniowo-fosforanowej i stężenia 25(OH)D, a w przypadku potwierdzenia zaburzeń włączenia leczniczych dawek witaminy D.
Głównym celem naszej pracy było zbadanie wpływu stanu zaopatrzenia organizmu w witaminę D na procesy metaboliczne i mineralizacyjne zachodzące w rozwijających się kościach. Wyniki badania nie wykazały istotnych statystycznie różnic w stężeniu markerów kostnych pomiędzy grupami niemowląt, chociaż wyraźnie obserwowano wyższe stężenia osteoprotegryny, sRANKL, CrossLaps i CICP w grupie niemowląt z stężeniem 25(OH)D pomiędzy 30–80ng/ml.
Innym ciekawym zagadnieniem ujawnionym w naszej pracy jest zależność między stężeniem PTH i 25(OH)D w organizmie. Dane z literatury wskazują, że stężenie PTH może być swoistym, czynnościowym wykładnikiem dostępności wewnątrzustrojowych zasobów witaminy D i jest podwyższone w przypadku niedoboru witaminy D [20–23]. W naszym badaniu wykazano istotne statystycznie różnice w stężeniu PTH w obrębie badanych grup niemowląt. Co więcej, średnie stężenie PTH w grupie I z najniższym stężeniem witaminy D było blisko dwukrotnie wyższe niż w grupie II. Na podstawie uzyskanych wyników można by polemizować, czy sugerowane minimalne stężenie witaminy D 20 ng/ml pozostaje do końca stężeniem wystarczającym dla osiągnięcia pełnych korzyści płynących z jej działania (chociaż mamy świadomość, że nasze badanie dotyczyło mało licznej populacji).
W podsumowaniu wyników należy stwierdzić, że objawy ze strony układu kostnego u niemowląt odzwierciedlane przez markery obrotu kostnego są również związane z procesami metabolicznymi i mineralizacyjnymi zachodzącymi w rozwijającym się kośćcu, a nie jedynie ze stanem zaopatrzenia organizmu w witaminę D. Należy zwrócić również uwagę na powszechnie występujący problem często błędnego rozpoznawania krzywicy u niemowląt z rozmiękaniem potylicy czy dużymi rozmiarami ciemiączka. Zatem przed podjęciem decyzji o leczeniu dużymi dawkami witaminy D rekomendujemy w każdym przypadku wykonanie szczegółowej diagnostyki gospodarki wapniowo-fosforanowej.
Wnioski
1. U żadnego z badanych niemowląt pomimo stwierdzanych zmian kostnych nie stwierdzono jawnego niedoboru witaminy D równoznacznego z rozpoznaniem krzywicy niedoborowej.
2. Przyczyny występowania objawów z układu kostnego u niemowląt mają charakter złożony, gdyż mogą być objawem nasilonych przemian metabolicznych zachodzących w kośćcu w wyniku procesu wzrastania, a nie zależeć jedynie od stanu zaopatrzenia organizmu w witaminę D.
3. Stwierdzenie statystycznie istotnych związków zależności między witaminą D a markerami kościotworzenia i resorpcji wydaje się potwierdzać fakt modyfikowania metabolizmu kostnego przez aktywną formę 1,25 (OH)2D.
4. Decyzja o leczeniu niemowlęcia z objawami krzywicy wysokimi dawkami witaminy D wymaga potwierdzenia hipowitaminozy D badaniami laboratoryjnymi.
Piśmiennictwo
1. Lorenc R.S., Kaczmarkiewicz E.; Znaczenie wapnia i witaminy D w optymalizacji masy kostnej oraz zapobieganiu i leczeniu osteoporozy u dzieci; Pediatria Współczesna 2001:3, 105–109
2. Specker B.; Nutrition Influences Bone Development from Infancy through Toddler Years; J. Nutr. 2004:134, 691S–695S
3. Pyrżak B., Witkowska E., Rymkiewicz-Kluczyńska B.; Wpływ hormonu wzrostu na strukturę i metabolizm kości u dzieci; konsekwencje niedoboru hormonu wzrostu i efekty leczenia substytucyjnego; Endokrynologia Pediatryczna 2004:3, 51–55
4. Ralston S.H.; Structure and metabolism of bone; Medicine 2005: 33,58–60
5. ; Saganowska R., Lalik B.: Osteoporoza u dzieci i młodzieży; Przegląd Pediatryczny 2006: 36, 143–150
6. Gajewska J., Ambrożkiewicz J., Raskowska-Klita T.; Wybrane markery obrotu kostnego w surowicy krwi dzieci w zależności od wieku i płci; Wiad. Lek. 2006:58, 476–480
7. Allgrove J.; Metabolic Bone Disease; Pediatrics and Child Health 2007:17, 253–259
8. Karalus J., Chlebna-Sokół D.; Optymalne stężenie witaminy D jako ważny czynnik rozwoju i utrzymania prawidłowej masy kostnej u dzieci i młodzieży; Endokrynologia Pediatryczna 2008:7, 75–82
9. Golec J., Chlebna-Sokół D.; Stan zaopatrzenia w witaminę D dzieci z niską masą kostną; Endokrynologia Pediatryczna 2011:10, 27–35
10. El-Hajj Fuleihan G., Nabulsi M., Choucair M. et al.; Hypovitaminosis D in healthy schoolchildren; Pediatrics 2001:107, e53
11. Talwar S.A., Swedler J., Yeh J. et al.; Vitamin D nutrition and bone mass in adolescent black girls; J. Natl. Med. Assoc. 2007:99, 650–657
12. Cheng S., Tylavsky F., Kröger H. et al.; Association of low 25-hydroxyvitamin D concentration with elevated parathyroid hormone concentration and low cortical bone density in early pubertal and prepubertal Finnish girls; Am. J. Clin. Nutr. 2003:78, 485–492
13. Wagner Cl., Greer F.R.; The Section on Breastfeeding and Committee on Nutrition, American Academy of Pediatrics. Prevention of riskets and vitamin D deficiency in infants, children and adolescents; Pediatrics 2008:122, 1142–145
14. Bagnoli F., Casucci M., Rossetti A. et al.; Vitamin D as a drug; Journal of Maternal-Fetal and Neonatal Medicine 2011:24, 7–11
15. Czech-Kowalska J., Pludowski P., Dobrzańska A. et al.; Impact of vitamin D supplementation on markers of bone mineral metabolism in term infants; Bone 2012:51,781–786
16. Whyte M., Thakker R.; Riskets and osteomalacia; Medicine 2005:33,70–74
17. Tallerman K.H.; Craniotabes in Fourth Months Old Twins; Proceeding of the Royal Society of Medcine 1934:27,1324–1325
18. Fox G.N., Maier M.K.; Neonatal Craniotabes; Am. Fam. Physician 1984:30, 149–151
19. Yorifuji J., Yorifuji T., Tachibana K. et al.; Craniotabes in Normal Newborns: The Earliest Sign of Subclinical Vitamin D Deficiency; J. Clin. Endocrinol. Metab. 2008:93, 1784–1788
20. Christakos S., Ajibade D.V., Dhawan P. et al.; Vitamin D: Metabolism; Endocrinol. Metab. Clin. North. Am. 2010:39, 243–253
21. Lieben L., Carmeliet G., Masuyama R.; Calcemic actions of vitamin D: Effects on the intestine, kidney and bone; Best Practice and Research Clinical Endocrinology and Metabolism 2011:25, 561–572
22. Harkness L., Cromer B.; Low levels of 25-hydroxy vitamin D are associated with elevated parathyroid hormone in healthy, adolescent females; Osteoporosis International 2005:16, 109–113
23. Prentice A., Goldberg G., Schoenmakers I.; Vitamin D across the lifecycle: physiology and biomarkers; Am. J. Clin. Nutr. 2008:88, 500S–506S








