Endokrynol. Ped. 12/2013;3(44):31-46
DOI: 10.18544/EP-01.12.03.1456
Stężenia IL-6, TNF-α i INF-γ we krwi u dziewcząt z zaburzeniami odżywiania (jadłowstręt psychiczny contra otyłość)
1Katedra i Klinika Pediatrii Zabrze, ŚUM Katowice
2Oddział Pediatrii Szpital Miejski, Ruda Śląska
3Katedra i Zakład Mikrobiologii i Immunologii Zabrze, ŚUM Katowice
Słowa kluczowe: cytokiny, IL-6, TNF-α, IFN-γ, jadłowstręt psychiczny, otyłość
Streszczenie
Nadprodukcja IL-6, TNF-α i IFN-γ może prowadzić do jadłowstrętu i wyniszczenia u osób z przewlekłymi zapaleniami i nowotworami. Brakuje badań oceniających porównawczo profil IL-6, TNF-α i IFN-γ we krwi u osób ze skrajnym niedożywieniem i otyłością. Cel pracy. Ocena profilu stężeń IL-6, TNF-α i IFN-γ we krwi u dziewcząt z anorexia nervosa (AN) w porównaniu do otyłych (OT) i zdrowych (ZD) oraz analiza zależności pomiędzy stężeniem tych cytokin a masą ciała, BMI i stężeniem insuliny (INS). Materiał i metody. U 30 dziewcząt z AN (śr. BMI-SDS: -2,93 ± 0,41), 30 z OT (śr. BMI-SDS: 6,41 ± 0,8) i 20 ZD (śr. BMI-SDS: 0,17 ± 0,54) oznaczono stężenia IL-6, TNF-α i IFN-γ w surowicy metodą ELISA, a INS metodą IRMA. Wyniki. Średnie stężenie IL-6 w surowicy krwi u AN (2,32 ± 0,76 pg/ml) było podobne do średnich stężeń tej cytokiny u ZD (1,98 ± 0,45 pg/ml), ale istotnie niższe niż u OT (12,66 ± 9,31 pg/ml) (p< 0,05). Także średnie stężenie TNF-α w surowicy krwi w grupie AN (0,68 ± 0,13 pg/ml) było znamiennie niższe niż u OT (1,71± 0,63) (p< 0,05), ale podobne jak u ZD (0,99 ± 0,72 pg/ml). Z kolei średnie stężenie IFN-γ w surowicy krwi wynosiło 1,31 ± 0,58 pg/ml u AN, było znamiennie niższe niż u OT (6,15 ± 2,46 pg/ml) (p< 0,01) i nie różniło się istotnie w porównaniu do ZD (1,5 ± 0,57 pg/ml). Wykazano istotne statystycznie dodatnie korelacje pomiędzy stężeniem IL-6, TNF-α i IFN-γ we krwi a masą ciała, BMI i wskaźnikiem Cole’a w całej badanej grupie (AN, OT, ZD). Wykazano też znamienne statystycznie dodatnie korelacje pomiędzy stężeniem IL-6 (r= 0,24; p< 0,05) i IFN-γ (r= 0,29; p < 0,05) a stężeniem INS we krwi u wszystkich badanych łącznie. Nie było takich korelacji w obrębie poszczególnych grup. Wnioski. 1. Niższe stężenia IL-6, TNF-α i IFN-γ we krwi u dziewcząt z AN niż u OT mogą być wyrazem mechanizmów adaptacyjnych zapobiegających utracie masy ciała, a nie czynnikiem sprawczym wychudzenia. 2. Korelacja pomiędzy stężeniem tych cytokin we krwi a BMI może wskazywać, że niska ich zawartość w AN wynika ze zmniejszenia ilości tkanki tłuszczowej. 3. Dodatnia korelacja pomiędzy stężeniem badanych cytokin a stężeniem INS wyłącznie w całej badanej grupie, gdzie obserwuje się duży rozrzut wartości masy ciała, może dowodzić, że te cytokiny odgrywają rolę w modelowaniu insulinooporności zależnie od masy ciała
Wstęp
Nadprodukcja niektórych cytokin może prowadzić do jadłowstrętu, niedożywienia i wyniszczenia u osób z przewlekłymi zapaleniami. U chorych z kacheksją nowotworową stwierdza się podwyższone stężenia IL-6, TNF-α i IFN-γ we krwi. Obserwacje wskazują, że u chorych z AIDS niektóre cytokiny, np. IL-1, IL-6, IL-8, TNF-α, są zaangażowane w regulację poboru pokarmu i rozwój zespołu anorexia-cachexia, a egzogenne podawanie cytokin może wyidukować brak apetytu i doprowadzić do znacznego zmniejszenia masy ciała [1, 2].
Interleukina 6 (IL-6), inaczej interferon β 2 (IFN β2), czynnik 2 stymulujący limfocyty B (B cell stimulating factor 2, BSF-2), czynnik różnicowania limfocytów B (B cell differentiating factor, BCDF), czynnik wzrostu hybrydoma (hybridoma growth factor), została odkryta początkowo jako czynnik różnicowania limfocytów B posiadający aktywność IFN-β2. IL-6 to homodimer (19-26 kDa) działający poprzez receptor IL-6R, występujący w formie przezbłonowej i rozpuszczalnej (sIL-6R) [3, 4]. IL-6 wykazuje plejotropowe działanie w regulacji odpowiedzi immunologicznej, odpowiedzi ostrej fazy, hematopoezie i zapaleniu [3, 4].
IL-6 pod wpływem stymulacji jest produkowana przez limfocyty T i B, granulocyty, komórki mięśni gładkich, eozynofile, chondrocyty, osteoblasty, komórki tuczne, glejowe i keratynocyty. W uogólnionych stanach zapalnych jej głównym źródłem są komórki śródbłonka, fibroblasty, makrofagi i monocyty [3, 4]. Przy braku aktywnego procesu zapalnego aż 15–30% krążącej w surowicy IL-6 jest produkowane w tkance tłuszczowej [5]. Również mięśnie szkieletowe produkują IL-6, a jej stężenie we krwi wzrasta w wyniku ćwiczeń fizycznych [6]. IL-6 jest współodpowiedzialna za rozwój kacheksji [3].
Badania wskazują, że IL-6 wpływa na gospodarkę węglowodanową, zwiększając insulinooporność [5, 7]. Wysokie stężenia IL-6 we krwi obserwowano u osób otyłych z hiperinsulinemią [6]. Może być też czynnikiem predykcyjnym cukrzycy typu 2 [8].
Czynnik martwicy nowotworu (tumor necrosis factor, TNF-α), inaczej kacheksyna czy kachektyna (z łac. cachexia – wyniszczenie, ang. cachectin), jest cytokiną z nadrodziny TNFSFL, wyizolowaną po raz pierwszy jako rozpuszczalny czynnik powodujący śmierć przeszczepionych guzów [3]. TNF-α to glikoproteina zawierająca 157 aminokwasów, powstająca w wyniku obróbki potranslacyjnej 233 aminokwasowego polipeptydu [9]. TNF-α działa za pośrednictwem receptora TNF-R1 (białko p55; 55 kDa) i TNF-R2 (białko p75; 75 kDa), których ekspresja jest stwierdzana na komórkach immunokompetentnych [10].
TNF-α jest produkowany głównie przez aktywowane monocyty i makrofagi oraz w mniejszych ilościach przez adipocyty, keratynocyty, fibroblasty, neutrofile, mastocyty, komórki śródbłonka oraz niektóre limfocyty [3].
Działanie TNF-α jest wielokierunkowe. Uczestniczy w hamowaniu rozwoju guzów nowotworowych i hamowaniu replikacji wirusów. Bierze udział w odpowiedzi ostrej fazy, pobudzając wątrobę do produkcji białek ostrej fazy [3, 10]. TNF-α wpływa na zwiększenie insulinooporności tkanek obwodowych [5, 8, 10].
TNF-α ma wpływ na aktywację osi podwzgórze- przysadka- nadnercza. Bierze udział w regulacji apetytu [11].
Efekt biologiczny TNF-α zależy od intensywności jego wydzielania. Nadmierne wydzielanie TNF-α może prowadzić do kacheksji. Odgrywa bowiem znaczącą rolę w degradacji tkanki tłuszczowej, indukując apoptozę komórek tłuszczowych oraz w zaniku tkanki mięśniowej, hamując syntezę lipazy lipoproteinowej [3, 8, 12, 13].
Interferon-γ (IFN-γ), zidentyfikowany po raz pierwszy w roku 1960 spośród członków rodziny IFN typu II, należy do grupy cytokin glikoproteinowych wytwarzanych przez komórki w odpowiedzi na obecność patogenów, takich jak wirusy, bakterie, pasożyty czy komórki nowotworowe [3, 4].
IFN-γ to homodimer (34 kDa) działający poprzez dwa receptory: IFNGR1 i IFNGR2. W przeciwieństwie do interferonu- α i interferonu- β, których ekspresja jest stwierdzana we wszystkich komórkach, źródłem wytwarzania INF-γ są komórki wrodzonego układu immunologicznego (NK, NKT, makrofagi i komórki mielomonocytarne) oraz nabytego systemu odpornościowego (komórki T helper, komórki T cytotoksyczne i komórki B) [4].
IFN-γ posiada właściwości przeciwwirusowe, immunoregulacyjne i przeciwnowotworowe [3, 4]. Pełni ważną rolę w odporności wrodzonej i nabytej. Wykazano też jego udział w patogenezie niektórych schorzeń, np. cukrzycy typu 1 czy reumatoidalnego zapalenia stawów [4]. Wraz z IL-1, IL-2, IL-6, TNF-α odgrywa rolę w wystąpieniu zespołu anorexia-cachexia u chorych na nowotwory [13].
Jadłowstręt psychiczny (anorexia nervosa, AN) to zespół psychosomatyczny zaczynający się najczęściej w okresie adolescencji, w którym chorzy świadomie ograniczają przyjmowanie pokarmów celem osiągnięcia szczupłej sylwetki ciała. Prowadzi to do znacznego niedoboru masy ciała, spadku BMI poniżej normy, a często wręcz do skrajnego wyniszczenia [14].
U chorych z AN prowadzono badania dotyczące IL-6, TNF-α, IFN-γ w kulturach hodowli leukocytów in vitro [15–18]. Były też nieliczne badania oceniające stężenia tych cytokin w surowicy krwi lub w innych płynach ustrojowych, a także ekspresję w tkance tłuszczowej w AN. Wyniki tych obserwacji są rozbieżne. Jedni autorzy notowali wyższe stężenia we krwi IL-6 czy TNF-α u pacjentów z AN w porównaniu do zdrowych [19, 20], inni zaś nie wykazywali zmian [21]. Większość prac dotyczy kobiet dorosłych, choć są też pojedyncze publikacje odnoszące się do dziewcząt z AN [22–25]. Z reguły autorzy porównują grupę chorych z AN do grupy zdrowych z prawidłową masą ciała. Tylko pojedyncze doniesienia tyczą porównania wyników oznaczeń tych cytokin do wyników uzyskanych u otyłych [26]. Brakuje też odniesienia stężeń IL-6, TNF-α, IFN-γ we krwi do masy ciała i innych parametrów stanu odżywienia, jak BMI czy wskaźnik Cole’a w AN.
W stanach otyłości notuje się nadmierną produkcję IL-6, TNF-α, białka C-reaktywnego (CRP), których stężenie we krwi koreluje dodatnio z BMI [27].
Wiadomo, że TNF-α ma znaczenie w patogenezie insulinooporności. Także wzrost stężenia IL-6 we krwi u otyłych wiąże się z upośledzeniem tolerancji glukozy i insulinoopornością. W dostępnym piśmiennictwie brakuje doniesień na temat zależności pomiędzy stężeniem IL-6, TNF-α, IFN-γ a stężeniem insuliny we krwi u chorych z jadłowstrętem psychicznym.
Cel pracy
1. Ocena stężeń IL-6, TNF-α i INF-γ w surowicy krwi u dziewcząt z jadłowstrętem psychicznym w porównaniu do dziewcząt z otyłością prostą i zdrowych.
2. Analiza zależności pomiędzy stężeniem wymienionych cytokin we krwi a masą ciała i BMI w grupie z jadłowstrętem psychicznym i w całej badanej grupie dziewcząt.
3. Analiza korelacji pomiędzy stężeniem tych cytokin a stężeniem insuliny we krwi u dziewcząt z jadłowstrętem psychicznym i w całej badanej grupie.
Materiał i metodyka
Badania przeprowadzono u: 30 dziewcząt z anorexia nervosa typu restrykcyjnego (wg klasyfikacji DSM-IV) [28] (AN), leczonych w SP Szpitalu Klinicznym Nr 1 w Zabrzu, 30 dziewcząt z otyłością prostą (OT), rekrutowanych z Poradni Endokrynologicznych w Górnośląskim Centrum Pediatrii w Katowicach i SP SK Nr 1 w Zabrzu, oraz 20 dziewcząt zdrowych (ZD) – ochotniczek, uczennic szkół w Zabrzu. Badania te stanowiły kontynuację naszych wcześniejszych badań w tej samej grupie dziewcząt z AN, OT i ZD na temat oceny innych cytokin w surowicy krwi (IL-1α, IL-1β i IL-2).
W grupie AN badania wykonano w pierwszych 3 dniach hospitalizacji, przed rozpoczęciem terapii. U każdej z pacjentek wykluczono inne niż AN schorzenia somatyczne i psychiczne mogące być przyczyną wyniszczenia. U wszystkich był pierwotny lub wtórny brak miesiączki. Średni czas trwania choroby, tj. intensywnego odchudzania się, do momentu zgłoszenia się do szpitala wynosił 18,5 ± 5,91 miesiąca (3–60 miesięcy).
Średni wiek badanych w grupie AN wynosił 15,7 ± 0,5 lat, a średnia masa ciała: 38,7±1,3 kg (tab. I). U każdej badanej wyliczono BMI = [m. ciała (kg)] / wzrost (m)2 oraz odchylenie standardowe dla BMI: BMI-SDS (standard deviation score). Do oceny BMI-SDS posłużono się siatkami centylowymi BMI, opracowanymi przez Palczewską i wsp. dla płci i wieku, obowiązującymi w populacji polskiej [29]. Średni wskaźnik BMI w grupie AN wynosił 14,9 ± 0,6 kg/m2, a średnie BMI-SDS: - 2,93 ± 0,4 (tab. I). Obliczono wskaźnik Cole’a, odzwierciedlający stopień odżywienia. Kwalifikacja wskaźnika Cole’a obejmuje następujące zakresy: < 75% : wyniszczenie, 75–85% : niedożywienie; 85–90% : nieznaczne niedożywienie; 90–100%: norma; > 110%: nadmierne odżywienie [30].
Średni wskaźnik Cole’ a w grupie AN wynosił 76 ± 0,04% (tab. I).
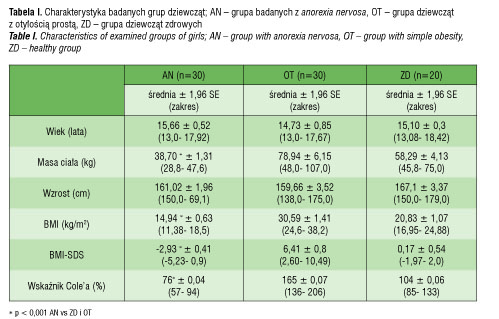
Do grupy OT zakwalifikowano dziewczęta w śr. wieku: 14,7±0,9 lat, których BMI wykraczało poza 97 centyl oceniony na podstawie siatek centylowych, a BMI-SDS było większe niż 2 odchylenia standardowe (tab. I). Żadna z badanych w tej grupie nie chorowała na choroby przewlekłe, nie stosowała leków na stałe ani na co najmniej miesiąc przed badaniem. Żadna nie stosowała diet ani innych sposobów odchudzania w ciągu ostatnich 3 miesięcy przed badaniem. Średnia masa ciała u OT wynosiła 78,9±6,2 kg, BMI: 30,6±1,4 kg/m2, BMI-SDS: 6,4±0,8, a wskaźnik Cole’a: 165±0,1 % (tab. I).
Wiek dziewcząt w grupie ZD wynosił średnio 15,1±0,3 lat, masa ciała: 58,3±4,1 kg, BMI: 20,8±1,1 kg/m2, BMI-SDS: 0,17±0,5, a wskaźnik Cole’a: 104±0,1% (tab. I). W dniu badań żadna z dziewcząt nie zgłaszała dolegliwości, nie miała ostrej infekcji w ciągu ostatniego miesiąca przed badaniem.
Badanie odbywało się między godz. 7.00 a 8.00 rano, na czczo, po co najmniej 12-godzinnym poszczeniu. Krew odwirowywano, a uzyskaną surowicę krwi przechowywano w temperaturze -70°C.
Na przeprowadzenie badań uzyskano zgodę Komisji Bioetycznej Śląskiego Uniwersytetu Medycznego (Uchwała nr KNW/0022/KBI/2/I/11
z dn.15.03.2011 r.) oraz zgodę pacjentek i ich rodziców lub opiekunów prawnych.
Oznaczanie surowiczych stężeń IL-6, TNF-α i IFN-γ wykonano metodą High Sensitivity Human ELISA kit (Enzyme Linked Immunoabsorbent Assay), przy użyciu zestawów firmy Abcam zgodnie z metodami podanymi przez producenta. Do pomiaru absorpcji użyto automatycznego czytnika Elx800 firmy BIO-TEK Instruments (USA) przy długości fali zalecanej przez producenta.
Oznaczenie stężenia insuliny (INS) i wysoko czułego białka CRP (hsCRP) określano przy pomocy analizatora biochemicznego Cobas 6000 firmy Roche (USA). Wszystkie oznaczenia przeprowadzono w Laboratorium Centralnym SP Szpitala Klinicznego Nr 1 w Zabrzu.
Analiza statystyczna
Do obliczeń statystycznych wykorzystano program Statistica v. 4.3 En. Przyjęto poziom istotności α = 0,05. Dla wszystkich parametrów sprawdzono zgodność ich rozkładów z rozkładem normalnym.
W ocenie zgodności posłużono się testem Shapiro-Wilka oraz histogramami zmiennych z naniesioną krzywą Gausa. Homogeniczność wariancji sprawdzono testem Levene’a. Dla zmiennych o rozkładzie normalnym stosowano testy parametryczne t z oddzielną oceną wariancji. Przeprowadzono również analizę wariancji wieloczynikowej ANOVA. Dla zmiennych, których rozkład odbiegał od rozkładu normalnego zastosowano testy nieparametryczne U Manna-Whitneya, ANOVA, Rang Kruskala-Wallisa, mediany, oraz test dla porównań wielokrotnych. Obliczono współczynniki korelacji Rang Spear mana.
Wyniki
Średni wiek dziewcząt w grupie anorexia nervosa nie różnił się od średniego wieku dziewcząt w grupach kontrolnych. W grupie AN średnia masa ciała, BMI, BMI- SDS oraz wskaźnik Cole’a były znamiennie niższe aniżeli w grupach OT i ZD (p < 0,001) (tab. I).
Ocena stężeń badanych cytokin (IL-6, TNF-α i IFN-γ) w surowicy krwi u dziewcząt z jadłowstrętem psychicznym w porównaniu do dziewcząt otyłych i zdrowych
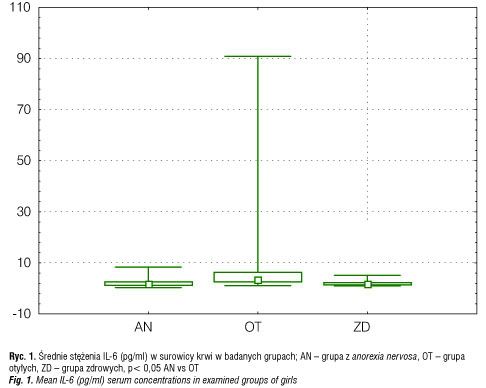
Średnie stężenie IL-6 w surowicy krwi u dziewcząt z AN (2,32 ± 0,76 pg/ml) było podobne do średnich stężeń tej cytokiny w grupie ZD (1,98 ± 0,45 pg/ml), ale istotnie statystycznie niższe niż u OT (12,66 ± 9,31 pg/ml) (p< 0,05) (tab. II, ryc. 1).
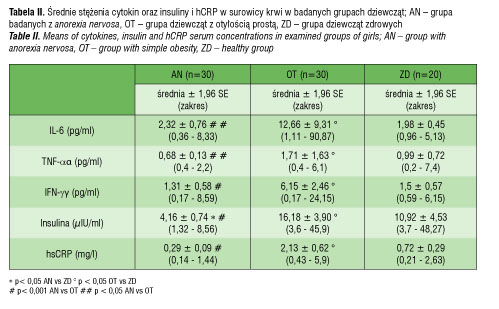
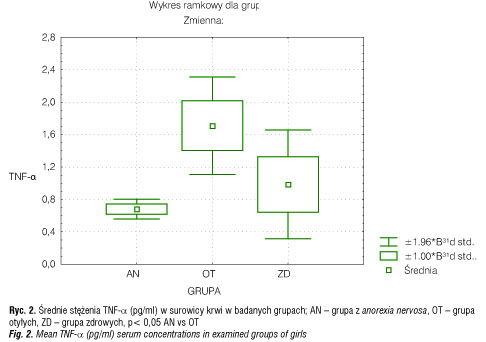
Średnie stężenie TNF-α w surowicy krwi u dziewcząt z AN (0,68 ± 0,13 pg/ml) było także znamiennie statystycznie niższe niż u OT (1,71± 0,63) (p< 0,05), ale podobne jak u ZD (0,99 ± 0,72 pg/ml) (tab. 2, ryc. 2). Z kolei średnie stężenie IFN-γ w surowicy krwi wynosiło 1,31 ± 0,58 pg/ml w grupie AN i było istotnie statystycznie niższe niż u OT (6,15 ± 2,46 pg/ml) (p< 0,01), ale nie różniło się znamiennie statystycznie w porównaniu do ZD (1,5 ± 0,57 pg/ml) (tab. II, ryc. 3).
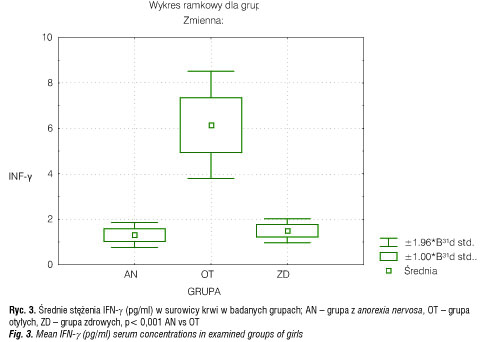
Natomiast porównując stężenia badanych cytokin w surowicy krwi grupy OT i ZD wykazano, iż średnie stężenia IL-6, TNF-α oraz IFN-γ w surowicy krwi były istotnie wyższe (p< 0,05) u otyłych aniżeli u zdrowych dziewcząt (tab. II).
Średnie stężenie INS w surowicy krwi u dziewcząt z AN wynosiło 4,16 ± 0,74 µIU/ml i było istotnie statystycznie niższe niż w grupie OT (16,18 ± 3,90 µIU/ml; p< 0,001) i ZD (10,92 ± 4,53 µIU/ml p< 0,05). Jedynie u dwóch pacjentek otyłych i jednej zdrowej stężenie INS w surowicy krwi było powyżej normy (norma: 2,6–24,9 µIU/ml). Średnie stężenie INS w surowicy krwi w grupie OT było istotnie statystyczne wyższe aniżeli w grupie ZD dziewcząt (p< 0,05) (tab. II).
Średnie stężenie hsCRP w surowicy krwi u chorych z AN (0,29 ± 0,09 mg/l) było najniższe i różniło się znamiennie statystyczne w porównaniu do grupy OT (2,13 ± 0,62 mg/l; p< 0,001), ale nie różniło się istotnie od dziewcząt ZD (0,72 ± 0,29 mg/l) (tab. II). U żadnej badanej z AN i ZD nie było podwyższonego stężenia hsCRP w surowicy krwi, natomiast u trzech otyłych dziewcząt stężenie hsCRP było podwyższone (norma: 0–5 mg/l). Wykazano też, że średnie stężenie hsCRP u OT było istotnie statystyczne wyższe aniżeli u ZD (0,72 ± 0,29 mg/l) (tab. II).
Nie wykazano zależności pomiędzy długością trwania choroby u dziewcząt z AN a stężeniem we krwi badanych cytokin, INS i hsCRP.
Analiza zależności pomiędzy stężeniem wymienionych cytokin we krwi a masą ciała, BMI i wskaźnikiem Cole’a w grupie z anorexia nervosa, z otyłością i zdrowych oraz w całej badanej grupie dziewcząt
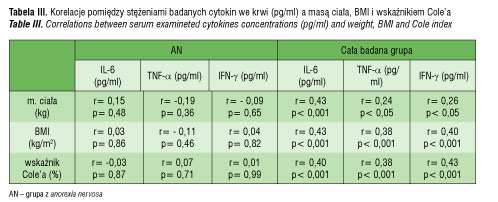
Nie zaobserwowano korelacji pomiędzy stężeniem badanych cytokin we krwi a masą ciała, BMI i wskaźnikiem Cole’a zarówno u dziewcząt z AN, jak i w grupie OT i ZD dziewcząt. Wykazano natomiast istotne statystycznie dodatnie korelacje pomiędzy stężeniem IL-6, TNF-α i IFN-γ we krwi a masą ciała, BMI i wskaźnikiem Cole’a w całej badanej grupie łącznie (AN, OT, ZD) (tab. III).
Analiza korelacji pomiędzy stężeniem badanych cytokin a stężeniem insuliny i hsCRP we krwi u dziewcząt z anorexia nervosa, z otyłością i zdrowych oraz w całej badanej grupie
W całej badanej grupie dziewcząt łącznie (AN, OT, ZD) zaobserwowano silną dodatnią korelację pomiędzy stężeniem we krwi hsCRP oraz insuliny a masą ciała (r= 0,71, p< 0,01; r= 0,55, p< 0,001 odpowiednio), a BMI (r= 0,84, p< 0,001; r= 0,74, p< 0,001 odpowiednio) i wskaźnikiem Cole’a (r= 0,82, p< 0,001; r= 0,73, p< 0,01 odpowiednio). W grupie AN obserwowano tylko dodatnią istotnie statystyczną korelację pomiędzy stężeniem hsCRP a BMI (r= 0,44; p< 0,05). Nie było takich zależności pomiędzy hsCRP a masą ciała ani wskaźnikiem Cole’a. Podobnie nie było zależności statystycznie znamiennych pomiędzy stężeniem INS we krwi a masą ciała, BMI ani wskaźnikiem Cole’a w grupie dziewcząt z AN.
Wykazano znamienne statystycznie dodatnie korelacje pomiędzy stężeniem IL-6 (r= 0,24; p< 0,05) i IFN-γ (r= 0,29; p < 0,05) a stężeniem INS we krwi u wszystkich badanych łącznie. W obrębie grup badanych dziewcząt (AN i ZD) nie zanotowano korelacji znamiennych statystycznie pomiędzy stężeniem INS a stężeniem wszystkich badanych cytokin we krwi. W grupie dziewcząt OT wykazano natomiast ujemną korelację istotną statystycznie pomiędzy stężeniem insuliny a stężeniem TNF-α we krwi (r = -0,54; p< 0,05).
Ponadto w całej badanej grupie dziewcząt łącznie wykazano statystycznie istotne ujemne zależności pomiędzy stężeniem hsCRP a stężeniem IL-6, TNF-α i IFN-γ we krwi. Nie było zależności dotyczących tych parametrów w obrębie grupy dziewcząt z AN, OT i ZD.
Dyskusja
Pierwszą badaną przez nas cytokiną była IL-6. Badania wykazały, że średnie stężenia IL-6 w surowicy krwi były podobne u dziewcząt z AN i u zdrowych. Natomiast były istotnie statystycznie niższe u chorych z AN w porównaniu z otyłymi. Podobne obserwacje poczynili inni autorzy [1,22,31,32]. Nieliczni tylko autorzy [19,33] obserwowali podwyższone stężenie IL-6 w surowicy krwi u chorych z AN, które ulegało obniżeniu po realimentacji do wartości obserwowanych u zdrowych.
Kahl i wsp. [23] przeprowadzili badanie ekspresji mRNA IL-6 we krwi metodą PCR u 11 dziewcząt z AN (śr. wiek: 16 ± 1,7 lat; śr. BMI: 14,8 ± 1,3 kg/m2) przed leczeniem oraz po uzyskaniu przyrostu masy ciała. Stwierdzili znamiennie statystycznie wyższe poziomy ekspresji tej cytokiny we krwi u chorych z AN w ostrej fazie choroby w porównaniu do grupy kontrolnej dziewcząt z prawidłową masą ciała. Po uzyskaniu przyrostu masy ciała i BMI w grupie z AN zaobserwowali spadek poziomu mRNA IL-6. Wykazali ujemną korelację pomiędzy poziomem ekspresji IL-6 a BMI, sugerując, że IL-6 może odgrywać rolę w ostrej fazie jadłowstrętu psychicznego.
Ponieważ udowodniono, że IL-6 jest produkowana także m.in. przez mięśnie szkieletowe, a jej stężenie wzrasta w wyniku ćwiczeń fizycznych [6], można domniemywać, że pacjentki z AN badane w ostrej fazie choroby przez tych autorów mogły stosować ćwiczenia fizyczne w celu odchudzania i stąd wzrastała u nich ekspresja mRNA IL‑6.
Brambilla i wsp. [31] badali stężenia IL-6 w surowicy krwi u kobiet z postacią restrykcyjną (AN-R), bulimiczno-oczyszczającą (AN-BP) jadłowstrętu psychicznego oraz u kobiet z bulimią (BN) przed rozpoczęciem leczenia, a także po miesiącu i po 3 miesiącach od początku terapii. Podstawowe stężenia IL-6 we krwi nie różniły się u badanych z AN-R i AN-BP (3,1 ± 4,6 pg/ml i 1,9 ± 0,9 pg/ml odpowiednio) i BN (1,3 ± 1,8 pg/ml) w porównaniu do kobiet zdrowych z grupy kontrolnej (2,0 ± 3,3 pg/ml). Przed terapią BMI kobiet z AN-R i AN-BP było istotnie niższe niż u zdrowych. Po 3-miesięcznej terapii BMI wzrosło istotnie w porównaniu do BMI wyjściowego, ale tylko u pacjentek z AN-R. Autorzy nie stwierdzili korelacji pomiędzy stężeniem IL-6 we krwi a BMI ani przed wdrożeniem leczenia, ani w trakcie leczenia.
W innym badaniu [34] ci sami autorzy, podobnie jak w poprzednim, nie wykazali różnic w stężeniach we krwi IL-6 u chorych z AN i w grupie kontrolnej ZD kobiet. Natomiast wykazali, podobnie jak Karczewska-Kupniewska i wsp. [33], istotnie niższe stężenie rozpuszczalnego receptora interleukiny 6 (sIL-6R) u kobiet z AN aniżeli u ZD. Nie zanotowali korelacji pomiędzy badaną interleukiną i jej rozpuszczalnym receptorem a BMI.
Inni badacze [32], jak cytowani autorzy i my w naszym badaniu, obserwowali u pacjentów z zaburzeniami odżywiania (AN i BN) wartości stężeń IL‑6 w surowicy krwi porównywalne do wartości występujących u osób zdrowych.
Udowodniono już wcześniej, że IL-6 jest jednym z czynników współodpowiedzialnych za rozwój kacheksji w przebiegu chorób nowotworowych [35,36]. Nie wydaje się prawdopodobne, aby ta interleukina była czynnikiem sprawczym wychudzenia u chorych na jadłowstręt psychiczny. Niskie stężenia tej cytokiny we krwi mogą raczej wynikać wtórnie z deficytu tkanki tłuszczowej, który jest spowodowany u chorych na AN przewlekłym głodzeniem i niedożywieniem. Wiadomo bowiem, że znaczącym źródłem IL-6 przy braku procesu zapalnego, potwierdzonym niskim stężeniem CRP we krwi, jaki zanotowaliśmy u dziewcząt z AN, jest tkanka tłuszczowa [5].
Nasze obserwacje wskazują na występowanie dodatniej korelacji pomiędzy stężeniem IL-6 we krwi a masą ciała, BMI i wskaźnikiem Cole’a
łącznie u wszystkich badanych (AN, OT i ZD), tj. w grupie z dużym rozrzutem wartości masy ciała.
Nie było takich zależności w obrębie poszczególnych grup. Dobranie do badań grupy osób otyłych miało na celu nie tylko sprawdzenie zależności pomiędzy masą ciała a stężeniem badanych cytokin, ale też kontrolę metodyki oznaczanych cytokin. Wiadomo od dawna, że otyłość jest przewlekłym stanem subzapalnym, w którym stwierdza się podwyższone stężenia we krwi CRP oraz cytokin prozapalnych, w tym IL-6 [5, 37, 38]. Nasze badanie także potwierdziło, iż stężenie CRP oraz IL-6 we krwi jest znamiennie wyższe u OT w porównaniu do ZD osób.
Niektórzy autorzy badali u osób z AN in vitro zdolność do produkcji IL-6 przez komórki PBMCs (peripheral blood mononuclear cells), zarówno spontaniczną, jak i stymulowaną mitogenami. Spontaniczna produkcja tej cytokiny była albo podobna jak u ZD osób [21, 26], albo niewykrywalna [15]. Natomiast produkcja IL-6 stymulowana lipopolisacharydami była u pacjentów z AN obniżona [15], a pod wpływem pobudzenia konkawaliną A podwyższona, lecz bez istotności statystycznej [26].
Dolezalova i wsp. [38] oprócz stężenia IL-6 w surowicy krwi oceniali również poziom ekspresji mRNA IL- 6 w podskórnej tkance tłuszczowej u 12 kobiet z AN. Nie wykazali różnic w średnich stężeniach IL-6 w surowicy krwi pomiędzy grupą AN (1,86 ± 0,38 pg/ml) a grupą ZD (2,85 ± 0,81 pg/ml). Natomiast poziom ekspresji mRNA IL-6 w tkance tłuszczowej był istotnie statystycznie niższy (p< 0,05) u chorych z AN aniżeli u ZD. Autorzy wnioskują, iż poziom ekspresji mRNA IL-6 w tkance tłuszczowej podskórnej nie stanowi odzwierciedlenia poziomów IL- 6 krążącej we krwi. W dyskusji podkreślają także, że nadal nie jest jasne, co jest źródłem produkcji cytokin prozapalnych w obrębie tkanki tłuszczowej, czy same adipocyty, czy raczej frakcje podścieliska tkanki tłuszczowej.
Lawson i wsp. [39] badali stężenia IL-6 oraz hsCRP w surowicy krwi u pacjentek z AN, które podzielono na dwie grupy: leczone i nieleczone estrogenami. Średnie stężenie IL-6 we krwi było wyższe u tych badanych z AN i zdrowych, które miały podwyższone stężenie hsCRP (> 3 mg/l) w porównaniu do tych z prawidłowym stężeniem hsCRP (0,86 ± 0,08 vs 0,59 ± 0,03 mg/l; p= 0,003). Także średnie stężenie IL-6 w surowicy było wyższe u kobiet z AN, które miały podwyższone stężenie hsCRP, niż u kobiet z AN z normalnym stężeniem hsCRP (0,84 ± 0,37 vs 0,59 ± 0,04 mg/l; p= 0,04). U chorych z AN zażywających estrogeny, mających podwyższone stężenia hsCRP, stężenia IL-6 we krwi były również wyższe w porównaniu do tych, które miały stężenia hsCRP w normie (0,84 ± 0,12 mg/l vs 0,51 ± 0,05 mg/l; p= 0,005).
W naszym badaniu wykazaliśmy istotną statystycznie dodatnią zależność pomiędzy stężeniem IL-6 a hsCRP we krwi w całej badanej grupie łącznie. Nie było korelacji w obrębie poszczególnych grup. Stężenie hsCRP we krwi było istotnie wyższe u dziewcząt OT w porównaniu do dziewcząt z grupy AN i ZD. We wcześniejszych pracach także wykazywano wyższe stężenia CRP we krwi u osób otyłych niż u tych z prawidłową masą ciała oraz dodatnią korelację z BMI [27]. U dzieci z otyłością prostą stwierdza się, podobnie jak u dorosłych, podwyższone stężenie CRP w surowicy, lecz nie zawsze podwyższone stężenie IL-6 i TNF-α [40]. Białko C-reaktywne jest proteiną ostrej fazy, produkowaną w wątrobie pod wpływem stymulacji przez IL-6. Czuła metoda oznaczania CRP (high sensitivity CRP, hsCRP) pozwala na przeprowadzenie analizy nawet bardzo niskich stężeń tego białka, których nie wykrywa się używając zwykłych, rutynowych metod laboratoryjnych. Stężenia hsCRP poniżej 1 mg/l we krwi dają niższe ryzyko zachorowania na choroby sercowo-naczyniowe, natomiast stężenia powyżej 2 mg/l znacznie zwiększają to ryzyko [41]. W naszym badaniu średnie stężenie hsCRP we krwi u dziewcząt z AN i ZD było niższe niż 1mg/l, natomiast u OT wyższe niż 2 mg/l. W całej badanej grupie dziewcząt wykazaliśmy dodatnią korelację nie tylko pomiędzy hsCRP a IL-6 we krwi, ale także pomiędzy hsCRP a TNF-α.
TNF-α jest pierwszą cytokiną, której udowodniono ścisły związek z przewlekłym stanem zapalnym o niskim natężeniu stwierdzanym w otyłości. Hotamisligil i wsp. [42] w roku 1993 jako pierwsi autorzy opisali wzrost stężenia TNF-α we krwi w czasie stosowania wysokoenergetycznej diety u gryzoni.
W naszym badaniu stężenia TNF-α we krwi u dziewcząt z AN były podobne jak u ZD, ale zdecydowanie niższe niż u OT. Wyniki badań dotyczących oceny stężeń TNF-α we krwi u pacjentów z AN są rozbieżne. Jedni autorzy notowali nieoznaczalne stężenia tego białka w surowicy krwi [15, 17, 19, 21], inni podobnie jak my nie stwierdzali różnic w stężeniach TNF-α w porównaniu do ZD [1, 31, 32, 43] Jeszcze inni zauważali wyższe stężenia TNF-α niż u ZD osób [20, 44].
Pomeroy i wsp. [19] dokonywali pomiaru stężeń TNF-α w surowicy krwi u chorych z AN przed i po uzyskaniu przyrostu masy ciała, porównując wyniki z wynikami oznaczeń tej cytokiny w grupie osób ZD. Zarówno w grupie z AN, jak i u zdrowych stężenia TNF-α były nieoznaczalne. Vaisman i wsp. [21] oraz Nagata i wsp. [15] także nie wykrywali TNF- we krwi u osób z AN.
Schattner i wsp. [17] nie wykrywali TNF- w surowicy krwi u młodych kobiet z AN (śr. wiek: 16,0 lat), natomiast stwierdzali u nich zwiększoną spontaniczną produkcję tej cytokiny przez komórki PBMCs in vitro (16 ± 5 U/ml) w porównaniu do ZD kobiet (4 ± 3 U/ml; p< 0,05). Produkcja TNF-α przez PBMCS po stymulacji fitohemaglutyniną (PHA) u chorych z AN była podobna jak u ZD, a po stymulacji lipopolisacharydami obniżona. Autorzy uważają, że brak wykrycia biologicznie aktywnej cząsteczki TNF-α w surowicy może być spowodowane zbyt krótkim okresem jej półtrwania. Natomiast odzwierciedleniem produkcji tego białka in vivo może być wielkość spontanicznej produkcji in vitro. Według nich zmniejszona zdolność do syntezy TNF-α pod wpływem stymulacji mitogenami u pacjentów z AN może wynikać z głębokiego niedożywienia. Wcześniejsze obserwacje pacjentów z ostrym niedożywieniem białkowo-kalorycznym wskazywały bowiem na spadek aktywności komórek NK (natural killer cells) u tych osób. Ponadto przewlekłe restrykcje pokarmowe prowadzące do niedożywienia białkowo-kalorycznego przyczyniają się do powstania niedoborów immunologicznych, a co za tym idzie do zwiększenia częstości występowania ciężkich powikłań infekcyjnych, atrofii grasicy i ubytku obwodowej tkanki limfoidalnej. Pacjenci z jadłowstrętem psychicznym często wykazują skłonność do leukopenii i względnej limfocytozy oraz zmniejszenia odpowiedzi opóźnionej w testach skórnych [14, 45].
Nova i wsp. [45] oceniali in vitro zdolność do produkcji TNF-α przez PBMCs u dziewcząt z AN w wieku 13–18 lat (w tym u 28 z AN-R i u 12
z AN-BP) pod wpływem stymulacji PHA. Stwierdzili istotnie statystycznie niższą produkcję TNF-α u dziewcząt z AN w porównaniu z grupą 35 ZD dziewcząt. Nie stwierdzili istotnego wzrostu syntezy tej cytokiny po miesiącu od wdrożenia leczenia i uzyskaniu przez chore przyrostu masy ciała i BMI. Według tych autorów duże różnice dotyczące wyników oznaczeń cytokin uzyskanych przez innych badaczy, którzy oceniali produkcję cytokin u chorych z AN, mogą wynikać z wielu czynników, potencjalnie oddziałujących na syntezę tych białek. Autorzy zaliczają do nich m.in. stosowanie u chorych z AN leków, np. fluoksetyny, czy stosowanie odmiennych metod odchudzania. Badania eksperymentalne prowadzone in vivo i in vitro pokazują bowiem, że podawanie fluoksetyny czy diazepamu skutkuje spadkiem proliferacji limfocytów indukowanej miogenami. Jednakże są też inne doniesienia na temat wpływu fluoksetyny na produkcję cytokin. Na przykład codzienne podawanie fluoksetyny przez 5 tygodni szczurom nie zaburza ekspresji TNF-α i IL-1β w śledzionie [45].
Wymienieni autorzy [45] zwracają także uwagę, że zmiany hormonalne obserwowane u chorych z AN, takie jak zmniejszone poziomy hormonów płciowych, wzrost sekrecji kortyzolu i β-endorfin mogą mieć wpływ na odporność komórkową. Podkreślają, że zależność pomiędzy układem neuroendokrynnym i immunologicznym jest dwukierunkowa. TNF-α jest cytokiną prozapalną, która wykazuje zdolność do aktywacji osi podwzgórzowo-przysadkowo-nadnerczowej i stymulacji sekrecji kortykosteronu przez nadnercza in vitro. Ekspresja innych cytokin, np. IL-1, może być z kolei hamowana przez glikokortykosteroidy.
Niektórzy autorzy, tak jak my w naszym badaniu, nie stwierdzali różnic w stężeniach TNF-α w surowicy krwi u chorych z AN w porównaniu do zdrowych. Brambilla i wsp. [34] nie notowali różnic pomiędzy stężeniem TNF-α w surowicy krwi oznaczanym metodą RIA u 14 chorych kobiet z AN, w tym u 9 z AN-R (19,6 ± 12,0 pg/ml) i u 5 z AN-BP (15,4 ± 2,6 pg/ml), a grupą 13 ZD kobiet (14,9 ± 5,1 pg/ml). Nie wykazali istotnej korelacji pomiędzy stężeniem TNF-α i rozpuszczalnymi receptorami sTNF-α-RI oraz sTNF-α-RII we krwi a BMI zarówno w grupie AN, jak i u ZD.
My także nie wykazaliśmy korelacji pomiędzy stężeniem TNF-α we krwi a BMI w grupie z AN i ZD. Była jednak istotna statystycznie dodatnia korelacja pomiędzy stężeniem TNF-α we krwi a masą ciała, BMI i wskaźnikiem Cole’a w całej badanej grupie (AN, OT, ZD), zapewne dzięki dużemu rozrzutowi wartości masy ciała.
Monteleone i wsp. [32] zaplanowali badania dotyczące oceny krążących we krwi cytokin, w tym TNF-α, u osób cierpiących na zaburzenia odżywiania, tj. AN i bulimię, zakładając teoretycznie, że ci właśnie chorzy mogą mieć głębokie zaburzenia funkcji w układzie immunologicznym. Założyli, że po pierwsze, w obu tych chorobach występują deficyty pokarmowe, a w badaniach eksperymentalnych u zwierząt i ludzi udowodniono już wcześniej, że niedożywienie może indukować wiele zaburzeń immunologicznych. Po drugie, system neuroendokrynny moduluje procesy immunologiczne, a w AN i BN są opisywane zmiany neuroendokrynne dotyczące nie tylko hormonów płciowych, ale i kortyzolu, opioidów i innych neurotransmitterów. Ponadto są pośrednie dowody na to, że stres i depresja, które często towarzyszą AN i BN, także mają wpływ na parametry immunologiczne, jednak poprzez niepoznane do tej pory mechanizmy.
Autorzy ci [32] zbadali stężenie TNF-α we krwi oraz stężenie rozpuszczalnych form białek receptora dla cytokin gp130 oraz LIF-R (leukemia inhibitory factor receptor) metodą ELISA u kobiet z AN i BN. Białka gp130 i LIF-R są składowymi kompleksu receptorów dla różnych cytokin i są włączone w transdukcję sygnału na drodze interakcji cytokina/receptor. Nie stwierdzili istotnych różnic w stężeniach TNF-α w surowicy krwi w obu badanych grupach w porównaniu do kobiet zdrowych, co może świadczyć o normalnej produkcji cytokiny u tych kobiet. Ponieważ stężenie gp130 i LIF-R było znamiennie wyższe wyłącznie u kobiet z AN i korelowało ujemnie z BMI, może to sugerować bezpośrednią zależność tych białek od ciężkości wyniszczenia.
Brambilla i wsp. [31] również oceniali stężenie TNF-α w surowicy krwi, ale metodą IRMA u kobiet z AN i BN w porównaniu do grupy kontrolnej ZD. Nie wykazali różnic znamiennych statystycznie w stężeniach krążącej we krwi TNF-α pomiędzy grupą z AN i BN a zdrowymi. Nie zanotowali także różnic w stężeniach tej cytokiny we krwi po upływie miesiąca i 3 miesięcy od zastosowania terapii łączonej (psychoterapia i farmakoterapia).
Protokół większości cytowanych badań zakładał przeprowadzenie oznaczeń z próbek krwi pobieranych w godzinach rannych, natomiast wcześniejsze badania doświadczalne dowiodły, że niektóre cytokiny, w tym TNF-α, mogą być wydzielane w rytmie dobowym o typie circadian, który może być odmienny u osób cierpiących na zaburzenia odżywiania w porównaniu do zdrowych [46]. Brambilla i wsp. [31] zastanawiają się, dlaczego chorzy z AN nie mają obniżonych stężeń cytokin we krwi. Twierdzą, że niejasne jest, dlaczego proste niedożywienie prowadzi do uogólnionej supresji układu immunologicznego, podczas gdy nie obserwuje się tego u chorych z AN, często skrajnie wyniszczonych. Wiadomo już, że pacjenci z AN wykazują często hyperaktywność w zakresie osi podwzgórze- przysadka- nadnercza, a ACTH i glikokortykosteroidy wywierają ujemne sprzężenie zwrotne z systemem immunologicznym i sekrecją cytokin. Według nich jednym z możliwych wyjaśnień dla niespodziewanie normalnych stężeń cytokin jest to, że kortykoliberyna, hormon wzrostu i β- endorfiny, których sekrecja jest wzmożona w AN, stymulują czynność układu immunologicznego [47]. Można tylko domniemywać, że hypersekrecja tych hormonów mogłaby stanowić mechanizm kompensacyjny przeciwko hamowaniu sekrecji cytokin spowodowanemu niedożywieniem i nadmierną aktywnością układu podwzgórzowo- przysadkowo- nadnerczowego. Innym wyjaśnieniem dla normalnych stężeń cytokin w AN jest to, że kobiety chorujące na AN wykonują często intensywne ćwiczenia fizyczne w celu osiągnięcia szczupłej sylwetki, a udowodniono, że stały trening fizyczny stymuluje układ immunologiczny.
Z kolei relatywnie oszczędne spożywanie produktów białkowych w porównaniu z innymi składnikami pokarmowymi w diecie kobiet z AN może przyczyniać się do immunosupresji, podobnie jak jest to obserwowane w przypadku innych deficytów białkowych. Pacjentki z AN badane przez nas także przyznawały się do stosowania diet restrykcyjnych z ograniczeniem produktów białkowych oraz do stosowania ćwiczeń fizycznych zapobiegających tyciu.
Niektórzy badacze poczynili jednak odmienne od naszych obserwacje. Kahl i wsp. [23] wykazali u dziewcząt z AN wyższą ekspresję mRNA TNF-α we krwi aniżeli u ZD dziewcząt. Zauważyli, że podwyższona ekspresja TNF-α utrzymywała się nawet po uzyskaniu przez chore wzrostu masy ciała i wskaźnika BMI. Dyskutuje się, czy zmiany poziomu ekspresji TNF-α są przyczyną, czy raczej efektem patofizjologicznych procesów występujących w AN.
W badaniach porównujących pacjentów z AN chronicznie niedożywionych do zdrowych z prawidłową masą ciała inni autorzy stwierdzali także znamiennie podwyższoną produkcję TNF-α u chorych z AN [21]. Na przykład Schattner i wsp. [48] stwierdzili wyższą spontaniczną syntezę TNF-α u pacjentów z AN w stosunku do ZD, która ulegała obniżeniu po realimentacji u tych chorych [16].
Z kolei badacze [44] oceniali stężenie TNF-α, receptorów TNF-R55 i TNF-R75 łącznie z markerami stanu oksydatywnego (selen, kwasu askorbinowy/ dehydroaskorbinowy, retinol, α- tokoferol, preroksydaza glutationu). Wykazali znamiennie wyższe stężenia TNF-α i wymienionych markerów u chorych z AN w porównaniu do ZD. Stężenia obu receptorów były wyższe u pacjentów z chorobą trwającą ponad rok w porównaniu do ZD oraz do tych osób z AN, u których choroba trwała krócej. Wykazali odwrotną korelację pomiędzy stężeniem obu receptorów a BMI i długością trwania choroby. Według tych autorów wskazuje to na możliwą rolę cytokin prozapalnych w rozwoju zaburzeń odżywiania.
Jeszcze inni autorzy [16] badali in vitro spontaniczne wydzielanie TNF-α przez limfocyty u kobiet z AN, wykazując znamiennie wyższą jej produkcję u tych chorych w porównaniu do ZD kobiet (16 ± 5 vs 4 ± 3 mU/ml). W trakcie realimentacji stwierdzili powrót wydzielania TNF-α do normy. Doszli więc do wniosku, że zmiany dotyczące cytokin u chorych z AN zależą raczej od stopnia niedożywienia, a nie neuroimmunomodulacji. Wiadomo, że wzrost wydzielania TNF-α może prowadzić do supresji poboru jedzenia i może zwiększać metabolizm tkankowy. Wyniki te sugerują, że wczesnym celem terapeutycznym w AN powinna być przede wszystkim rehabilitacja żywieniowa.
Mechanizm katabolicznego działania TNF-α jest nadal dyskutowany [23]. Uważa się, że TNF-α może zaburzać szybkość reagowania wrażliwych na glukozę neuronów w centrach odżywiania w bocznym podwzgórzu. Inny prawdopodobny mechanizm to redukcja transkrypcji enzymów lipogenicznych, prowadząca do zmniejszenia wewnątrzkomórkowych zapasów lipidów. Jednakże właściwa rola patofizjologiczna TNF-α w rozwoju kacheksji nadal pozostaje nieznana.
Cytokiną, której znaczenie zostało udowodnione w rozwoju zespołu anorexia-cachexia w przebiegu schorzeń nowotworowych, jest IFN- γ [13]. Można przypuszczać, że ta cytokina może być także odpowiedzialna za wyniszczenie w AN. Jednak większość przedstawianych dalej badań wskazuje na to, że produkcja IFN-γ u chorych na AN jest niewielka. Być może stanowi to jeden z mechanizmów adaptacyjnych, zapobiegających utracie masy ciała u tych osób.
Wyniki przedstawiane przez różnych autorów są nieco rozbieżne. Może to wypływać stąd, że do badań używano odmiennych mitogenów do stymulacji PBMCs (fitohemaglutynina, konkawalina A, lipopolisacharydy). Ponadto różnice te mogą być spowodowane odmiennością protokołów badań i różnicami w selekcji pacjentów (leczeni lub nieleczeni farmakologicznie).
Badania prowadzone przez nas nie wykazały różnic istotnych statystycznie w stężeniach IFN-γ we krwi pomiędzy grupą dziewcząt z AN a grupą ZD. U dziewcząt otyłych stężenia tej cytokiny były z kolei znamiennie statystycznie wyższe aniżeli u dziewcząt z AN i ZD.
Podobne wyniki uzyskali inni autorzy [1], którzy oceniali stężenie IFN-γ w surowicy krwi metodą ELISA u kobiet z AN w porównaniu do ZD. Nie wykazali oni istotnych różnic w stężeniach IFN-γ pomiędzy grupą pacjentek z AN (1,0 ± 0,2 pg/ml) a grupą ZD (0,9 ± 0,1 pg/ml; p= 0,7).
Nagata i wsp. [15] badali metodą ELISA zarówno stężenia krążącego we krwi IFN-γ, jak i spontaniczną oraz stymulowaną mitogenem (PHA) zdolność do produkcji tego białka przez limfocyty u dorosłych kobiet z AN-R przed i po uzyskaniu przez chore wzrostu masy ciała. Stężenia IFN-γ we krwi jak i spontaniczna synteza tej cytokiny były niewykrywalne nie tylko w grupie chorych z AN, ale także u kobiet ZD. Wykazali, że co prawda nastąpił wzrost produkcji IFN-γ przez limfocyty po stymulacji PHA z 915 ± 1004 pg/ml do 1984 ± 1848 pg/ml (p< 0,01), gdy masa ciała u chorych z AN zwiększyła się z 60 do 65% standardowej masy ciała, ale po dalszym wzroście masy ciała do 75% należnej nie obserwowano istotnych zmian (1934 ± 1821 pg/ml). Według autorów wyniki te mogą dowodzić, że raczej sam start, tj. początek wzrostu masy ciała, a nie bezwzględna wielkość masy ciała może być czynnikiem poprawiającym produkcję IFN-γ. Jednakże mechanizm nadal pozostaje nieznany. Potrzebne byłyby dalsze długofalowe obserwacje pozwalające na wyjaśnienie zależności pomiędzy funkcją układu immunologicznego, neuroendokrynnego czy autonomicznego i stanu psychicznego u chorych z AN.
Kolejni autorzy [26] nie wykazali różnic w zakresie spontanicznej zdolności do produkcji IFN-γ przez limfocyty u chorych z AN w porównaniu do zdrowych. Stwierdzili natomiast istotnie wyższą produkcję tej cytokiny w kulturach PBMCs po stymulacji konkawaliną A w grupie z AN (p= 0,027).
Z kolei inni badacze [17,18,49] obserwowali obniżoną produkcję IFN-γ przez komórki PBMCs u chorych z AN. Polack i wsp. [18] uważają, że być może jest to zależne od czynnościowego defektu dotyczącego limfocytów obwodowych, których zadaniem jest aktywacja syntezy cytokin. Autorzy zanotowali bowiem, że po podaniu limfocytów uzyskanych od osób zdrowych do hodowli limfocytów chorych na AN dochodziło do odwracalnego zwiększenia produkcji IFN-γ. Zauważyli też, że zdolność do syntezy tej cytokiny u chorych z AN wzrasta wraz ze zwiększaniem się masy ciała i powrotem cyklu miesiączkowego.
Schattner i wsp. [16] także wykazali zmniejszoną produkcję IFN-γ przez komórki PBMCs u kobiet z AN w porównaniu do ZD (172,5 ± 25 vs 367 ± 34 mU/ml). Produkcja tej cytokiny wracała do normy po uzyskaniu przez chore przyrostu masy ciała po rehabilitacji pokarmowej. Wnioskowali zatem, że zmiany w zakresie syntezy IFN-γ są związane właśnie z niedożywieniem.
Nasze badanie wykazało dodatnią korelację pomiędzy stężeniem IFN-γ we krwi a masą ciała, BMI oraz wskaźnikiem Cole’a w całej grupie badanych. Może to wskazywać, że stężenie tej cytokiny we krwi jest zależne od stopnia odżywienia.
Jeszcze inne wyniki przedstawili Nova i wsp. [45]. Badali in vitro produkcję IFN-γ przez komórki PBMCs po stymulacji PHA u dziewcząt (śr. wiek: 15,8 ± 1,5 lat) z AN-R i AN-BP przy przyjęciu do szpitala (śr. BMI: 15,38 ± 1,44 kg/m2) i po wypisie (śr. BMI: 17,05 ± 1,01 kg/m2; p< 0,01). Wykazali, że nie było znamiennych statystycznie różnic w produkcji IFN-γ u chorych przy przyjęciu do szpitala (śr. 119,7 pg/ml; zakres od 27,5 do 977,1 pg/ml) w porównaniu do ZD dziewcząt (śr. 322,0 pg/ml; zakres od 133,0 do 701,4 pg/ml; ns). Natomiast produkcja IFN-γ była istotnie niższa u dziewcząt z AN po wypisie ze szpitala (śr. 80,4 pg/ml; zakres od 29,1 do 464,5 pg/ml; p= 0,047) w porównaniu do ZD. Autorzy tłumaczą to tym, że okres hospitalizacji chorych był krótki i pacjentki nie spełniały jeszcze kryteriów powrotu do zdrowia, jak to było u chorych opisywanych przez innych autorów [17,48], u których nastąpił nie tylko przyrost masy ciała, ale i powrót miesiączek.
Interesujące wyniki przedstawili autorzy [40], którzy wykonywali oznaczenia stężeń IFN-γ w surowicy krwi w grupie młodych otyłych (śr. wiek: 17,2 ± 0,4 lat) i szczupłych osób (śr. wiek: 17,5 ± 0,3 lat). Choć stwierdzili istotnie wyższe stężenia INS i CRP w grupie otyłych adolescentów, podobnie jak my w naszym badaniu, to nie zanotowali istotnych różnic w stężeniach IFN-γ we krwi pomiędzy grupą OT (11,4 ± 8,0 pg/ml) a ZD osób (14,1 ± 12,8 pg/ml; p= 0,321). Stężenia innych cytokin prozapalnych (IL-6, TNF-α), które oceniali u badanych także nie różniły się znamiennie w obu grupach. Autorzy twierdzą, że być może stosunkowo krótki okres trwania otyłości u młodocianych powoduje, iż mimo stwierdzanej już u nich tendencji do insulinooporności nie dochodzi jeszcze do nadmiernego naciekania tkanki tłuszczowej makrofagami, co skutkowałoby nadprodukcją cytokin prozapalnych.
Celem naszych badań była także ocena zależności pomiędzy stężeniem insuliny a stężeniem cytokin we krwi u chorych z AN. Brakuje bowiem doniesień na ten temat.
Hotamisligil i wsp. [42], udowodnili, że TNF-α może modulować insulinowrażliwość. Badania prowadzone w następnych latach wykazały, że ta cytokina zwiększa insulinooporność tkanek obwodowych nie tylko bezpośrednio, ale również poprzez stymulację syntezy innych cytokin mających wpływ na wystąpienie insulinooporności, takich jak IL-6, IL-8 [5, 8, 10].
W naszym badaniu stężenia INS we krwi były najniższe w grupie AN, zaś najwyższe u OT. Do badań dobrano grupę dziewcząt z otyłością prostą, bez zaburzeń hormonalnych i bez cech zespołu metabolicznego i hiperinsulinizmu. Wykazano dodatnią zależność pomiędzy stężeniem INS a masą ciała i BMI. Chociaż nie było korelacji pomiędzy stężeniem TNF-α a stężeniem INS we krwi, to jednak zaobserwowane u otyłych dziewcząt wyższe średnie stężenia tego hormonu we krwi w porównaniu do ZD mogą wynikać z wyższych stężeń TNF-α w tej grupie dziewcząt. To może sugerować zagrożenie insulinoopornością u młodych dziewcząt z otyłością prostą. Aby to udowodnić, trzeba by było rozszerzyć badania o ocenę stopnia insulinooporności. Z kolei niskie stężenia TNF-α we krwi u dziewcząt z AN być może stanowią jeden z czynników adaptacyjnych wspomagających zachowanie insulinowrażliwości u tych chorych.
Nasze badania wykazały dodatnią korelację pomiędzy stężeniem INS a stężeniem IL-6 i IFN-γ we krwi w całej badanej. Nie było takich zależności w grupie AN, OT i ZD dziewcząt. Oceniane przez nas cytokiny były już wcześniej przedmiotem licznych badań w stanach otyłości u dorosłych i u dzieci, dlatego też grupa otyłych w naszym badaniu stanowiła jedynie drugą obok dziewcząt zdrowych grupę porównawczą dla badanych z AN.
Od dawna wiadomo, że nadprodukcja niektórych adipocytokin, w tym rezystyny, TNF-α, IL-6, CRP i innych prozapalnych cząsteczek, jak PAI-1 (plasminogen activated inhibitor), amyloid A, MIF (macrophage migration inhibitory factor), CSF1 (colony stimulating factor-1), MCP1 (monocyte chemoattractant protein-1), jest odpowiedzialna za rozwój przewlekłego stanu zapalnego o niewielkim nasileniu obserwowanego w otyłości [7, 50, 51].
Nasze badania wykazały, podobnie jak badania wielu autorów cytowanych w pracy poglądowej Ronti i wsp. [51], znamiennie wyższe stężenia IL-6, TNF-α, hsCRP oraz INS u dziewcząt z otyłością prostą w porównaniu do dziewcząt ZD, szczupłych. Jednak inni autorzy [40] w grupie młodzieży w wieku dojrzewania (średni wiek: 17,2 ± 0,4 lat) nie wykazali różnic w stężeniach IL-6 i TNF-α pomiędzy otyłymi i szczupłymi. Autorzy ci podkreślają, że u otyłych dzieci oraz u młodzieży w okresie adolescencji często notuje się podwyższenie stężenia we krwi CRP, bez wzrostu stężenia IL-6 i TNF-α. Jest to najprawdopodobniej wynik różnego stopnia insulinooporności wśród młodych adolescentów.
Wnioski
1. Stężenia IL-6, TNF-α i IFN-γ we krwi u dziewcząt z jadłowstrętem psychicznym są podobne jak u zdrowych i istotnie niższe w porównaniu do otyłych. Być może niskie stężenia tych cytokin we krwi są raczej wyrazem mechanizmów adaptacyjnych zapobiegających utracie masy ciała, a nie czynnikiem sprawczym wychudzenia u chorych z jadłowstrętem psychicznym.
2. Korelacja pomiędzy stężeniem IL-6, TNF-α i IFN-γ we krwi a BMI wskazywać może, że niska zawartość tych cytokin we krwi u chorych z jadłowstrętem psychicznym wynika ze zmniejszenia ilości tkanki tłuszczowej.
3. Dodatnia korelacja pomiędzy stężeniem IL-6, TNF-α i IFN-γ a stężeniem insuliny wyłącznie w całej badanej grupie, gdzie obserwuje się duży rozrzut wartości masy ciała, może wskazywać, że cytokiny te mogą odgrywać rolę w modelowaniu insulinooporności zależnie od masy ciała.
Piśmiennictwo
1. Corcos M., Guilbaud O., Chaouat G. et al.; Cytokines and Anorexia Nervosa; Psychosom. Med. 2001:63, 502-504
2. Plata-Salamán C.R., Sonti G., Borkoski J.P. et al.; Anorexia induced by chronic central administration of cytokines at estimated pathophysiological concentrations; Physiol. Behav. 1996:60, 867-875
3. Gołąb J., Jakóbisiak M., Lasek W. et al.; Immunologia; PZWL 2012
4. Akdis M., Burgler S., Crameri R. et al.; Interleukins, from 1 to 37, and interferon-γ: receptors, functions, and roles in diseases; J. Allergy. Clin. Immunol., Erratum in J. Allergy. Clin. Immunol. 2011:127, 701-721, 2011:128, 739
5. Bastard J.P., Maachi M., Lagathu C. et al.; Recent advances in the relationship between obesity, inflammation, and insulin resistance; Eur. Cytokine. Netw. 2006:17, 4-12
6. Pedersen B.K., Febbraio M.A.; Muscle as an endocrine organ: focus on muscle-derived interleukin-6; Physiol. Rev. 2008:88, 1379-1406
7. Jacobi D., Stanya K.J., Lee C.H.; Adipose tissue signaling by nuclear receptors in metabolic complications of obesity; Adipocyte 2012:1, 4-12
8. Bulcão C., Ferreira S.R., Giuffrida F.M. et al.; The new adipose tissue and adipocytokines; Curr. Diabetes Rev. 2006:2, 19-28
9. Horiuchi T., Mitoma H., Harashima S. et al.; Transmembrane TNF-alpha: structure, function and interaction with anti-TNF agents; Rheumatology (Oxford). 2010:49, 1215-1228
10. Himmerich H., Sheldrick A.J.; TNF-alpha and ghrelin: opposite effects on immune system, metabolism and mental health; Protein. Pept. Lett. 2010:17, 186-196
11. Ando T., Ishikawa T., Kawamura N. et al.; Analysis of tumor necrosis factor-alpha gene promoter polymorphisms in anorexia nervosa; Psychiatr. Genet. 2001:11, 161-164
12. Berthold-Losleben M., Heitmann S., Himmerich H.; Anti-inflammatory drugs in psychiatry; Inflamm. Allergy Drug. Targets 2009:8, 266-276
13. Kosacka M., Weryńska B., Gołecki M. et al.; The incidence and pathogenesis of cancer anorexia-cachexia syndrome in lung cancer; Pneumonol. Alergol. Pol. 2008:76, 360-365
14. Nogal P., Lewiński A.; Jadłowstręt psychiczny; Endokrynol. Pol. 2008:59, 148-155
15. Nagata T., Tobitani W., Kiriike N. et al.; Capacity to produce cytokines during weight restoration in patients with anorexia nervosa; Psychosom. Med. 1999:61, 371-377
16. Schattner A., Tepper R., Steinbock M. et al.; Cytokines in anorexia nervosa-nutritional or neuroimmunal changes?; Harefuah. 1992:123, 245-247
17. Schattner A., Tepper R., Steinbock M. et al.; TNF, interferon-gamma and cell-mediated cytotoxicity in anorexia nervosa; effect of refeeding; J. Clin. Lab. Immunol. 1990:32, 183-184
18. Polack E., Nahmod V.E., Emeric-Sauval E. et al.; Low lymphocyte interferon-gamma production and variable proliferative response in anorexia nervosa patients; J. Clin. Immunol. 1993:13, 445-451
19. Pomeroy C., Eckert E., Hu S. et al.; Role of interleukin-6 and transforming growth factor-beta in anorexia nervosa; Biol. Psychiatry. 1994:36, 836-839
20. Nakai Y., Hamagaki S., Takagi R. et al.:; Plasma concentrations of tumor necrosis factor-alpha (TNF-alpha) and soluble TNF receptors in patients with anorexia nervosa; J. Clin. Endocrinol. Metab. 1999:84, 1226-1228
21. Vaisman N., Barak Y., Hahn T. et al.; Defective in vitro granulopoiesis in patients with anorexia nervosa; Pediatr. Res. 1996:40, 108-111
22. Vaisman N., Hahn T.; Tumor necrosis factor-alpha and anorexia: cause or effect?; Metabolism 1991:40, 720-723
23. Kahl K.G., Kruse N., Rieckmann P. et al.; Cytokine mRNA expression patterns in the disease course of female adolescents with anorexia nervosa; Psychoneuroendocrinology 2004:29, 13-20
24. Gordon C.M., Goodman E., Emans S.J. et al.; Physiologic regulators of bone turnover in young women with anorexia nervosa; J. Pediatr. 2002:141, 64-70
25. Shimizu T., Satoh Y., Kaneko N. et al.; Factors involved in the regulation of plasma leptin levels in children and adolescents with anorexia nervosa; Pediatr. Int. 2005:47
26. Raymond N.C., Dysken M., Bettin K. et al.; Cytokine production in patients with anorexia nervosa, bulimia nervosa, and obesity; Int. J. Eat. Disord. 2000:28, 293-302
27. Brooks G.C., Blaha M.J., Blumenthal R.S.; Relation of C-reactive protein to abdominal adiposity; Am. J. Cardiol. 2010:106, 56-61
28. American Psychiatric Association; Diagnostic and Statistical Manual of Mental Disorder (DSM IV) APA; Washington D.C. 1994
29. Palczewska I., Niedźwiecka Z.; Wskaźniki rozwoju somatycznego dzieci i młodzieży warszawskiej; Med. Wieku Rozw. 2002:2, suppl I do nr 2
30. Lewitt A., Brzęczek K., Krupienicz A.; Interwencje żywieniowe w leczeniu anoreksji – wskazówki dietetyczne; Endokrynol., Otył. Zab. Przem. Mat. 2008:4, 128-136
31. Brambilla F., Bellodi L., Brunetta M. et al.; Plasma concentrations of interleukin-1 beta, interleukin-6 and tumor necrosis factor-alpha in anorexia and bulimia nervosa; Psychoneuroendocrinology 1998:23, 439-447
32. Monteleone P., Maes M., Fabrazzo M. et al.; Immunoendocrine findings in patients with eating disorders; Neuropsychobiology 1999:40, 115-120
33. Karczewska-Kupczewska M., Adamska A., Nikołajuk A.; Circulating interleukin 6 and soluble forms of its receptors in relation to resting energy expenditure in women with anorexia nervosa; Clin. Endocrinol. (Oxf). 2012:doi:10.1111/cen. 12118
34. Brambilla .F, Monti D., Franceschi C.; Plasma concentrations of interleukin-1-beta, interleukin-6 and tumor necrosis factor-alpha, and of their soluble receptors and receptor antagonist in anorexia nervosa; Psychiatry Res. 2001:103, 107-114
35. Braun T.P., Marks D.L.; Pathophysiology and treatment of inflammatory anorexia in chronic disease; J. Cachexia. Sarcopenia. Muscle 2010:1, 135-145
36. Bennani-Baiti N., Davis M.P.; Cytokines and cancer anorexia cachexia syndrome; Am. J. Hosp. Palliat. Care 2008:25, 407-411
37. Heilbronn L.K., Campbell L.V.; Adipose tissue macrophages, low grade inflammation and insulin resistance in human obesity; Curr. Pharm. Des. 2008:14, 1225-1230
38. Dolezalova R., Lacinova Z., Dolinkova M. et al.; Changes of endocrine function of adipose tissue in anorexia nervosa: comparison of circulating levels versus subcutaneous mRNA expression; Clin. Endocrinol. (Oxf) 2007:67, 674-678
39. Lawson E.A., Miller K.K., Mathur V.A. et al.; Hormonal and nutritional effects on cardiovascular risk markers in young women; J. Clin. Endocrinol. Metab. 2007: 92, 3089-3094
40. Cohen J.I., Maayan L., Convit A.; Preliminary evidence for obesity-associated insulin resistance in adolescents without elevations of inflammatory cytokines; Diabetol. Metab. Syndr. 2012:4, 26
41. Poledne R., Lorenzová A., Stávek P. et al.; Proinflammatory status, genetics and atherosclerosis; Physiol. Res. 2009:58, S111-118
42. Hotamisligil G.S., Shargill N.S., Spiegelman B.M.; Adipose expression of tumor necrosis factor-alpha: direct role in obesity-linked insulin resistance; Science 1993:259, 87-91
43. Krizova J., Papezova H., Haluzikova D. et al.; Soluble leptin receptor levels in patients with anorexia nervosa; Endocr. Res. 2002:28, 199-205
44. Agnello E., Malfi G., Costantino A.M. et al.; Tumour necrosis factor alpha and oxidative stress as maintaining factors in the evolution of anorexia nervosa; Eat. Weight. Disord. 2012:17, e194-199
45. Nova E., Samartín S., Gómez S. et al.; The adaptive response of the immune system to the particular malnutrition of eating disorders; Eur. J. Clin. Nutr. 2002:56, S34-37
46. Young M.R., Matthews J.P., Kanabrocki E.L. et al.; Circadian rhythmometry of serum interleukin-2, interleukin-10, tumor necrosis factor-alpha, and granulocyte-macrophage colony-stimulating factor in men; Chronobiol. Int. 1995:12, 19-27
47. Brambilla F., Ferrari E., Petraglia F.; Peripheral opioid secretory pattern in anorexia nervosa; Psychiatry Res. 1991:39, 115-127
48. Schattner A., Steinbock M., Tepper R. et al.; Tumour necrosis factor production and cell-mediated immunity in anorexia nervosa; Clin. Exp. Immunol. 1990:79, 62-66
49. Emeric-Sauval E., Polack E., Finkielman S. et al.; Interferon-gamma production and lymphocyte proliferative response in anorexia nervosa patients; Neuroendocrinol. Lett. 1991:13, 204
50. Corcos M., Guilbaud O., Paterniti S. et al.; Involvement of cytokines in eating disorders: a critical review of the human literature; Psychoneuroendocrinology 2003:28, 229-249
51. Ronti T., Lupattelli G., Mannarino E.; The endocrine function of adipose tissue: an update; Clin. Endocrinol. (Oxf) 2006:64, 355-365








