Endokrynol. Ped., 11/2012;4(41):64-72
DOI: 10.18544/EP-01.11.04.1430
Rola komórek T regulatorowych i dendrytycznych w nadczynności tarczycy
Klinika Endokrynologii i Diabetologii Dziecięcej UM w Lublinie
Słowa kluczowe: komórki T regulatorowe, komórki dendrytyczne, nadczynność tarczycy
Streszczenie
Schorzenia immunologiczne tarczycy to około 30% wszystkich chorób autoimmunologicznych. Badania ostatnich kilku lat potwierdziły istotną rolę komórek T regulatorowych i dendrytycznych w rozwoju schorzeń z autoagresji, w tym chorób gruczołu tarczowego, a szczególnie nadczynności tarczycy. Komórkom T regulatorowym CD4+CD25+Foxp3+ w ostatnich latach poświęca się wiele uwagi w związku z ich korzystnym wpływem na przebieg schorzeń autoimmunologicznych. Komórki dendrytyczne biorą udział w stymulacji odpowiedzi immunologicznej oraz
zapewnieniu tolerancji immunologicznej i z tego względu stały się jednym z głównych obiektów badań nad patogenezą chorób autoimmunologicznych. Należy sądzić, że zwiększenie populacji i stymulacja funkcji limfocytów T regulatorowych u chorych z nadczynnością tarczycy może w istotny sposób wpłynąć na poprawę wyników leczenia
Wstęp
Schorzenia immunologiczne tarczycy to około 30% wszystkich chorób autoimmunizacyjnych [1]. Do najczęściej występujących chorób tarczycy powstających w wyniku autoimmunizacji należą ● autoimmunologiczne zapalenia tarczycy (m.in. choroba Hashimoto, pierwotny zanik tarczycy
z niedoczynnością, limfocytarne zapalenie tarczycy) ● choroba Gravesa-Basedowa ● dystyreozy noworodków. Badania ostatnich kilku lat potwierdziły istotną rolę komórek T regulatorowych (Treg, ang. T regulatory cells) w rozwoju schorzeń z autoagresji, w tym chorób tarczycy, a szczególnie nadczynności tarczycy [2]. Doświadczenia z użyciem modeli zwierzęcych, a następnie badania komórek pozyskanych od osób chorych ujawniły korzystną rolę wzrostu odsetka i właściwości immunosupresyjnych Treg w hamowaniu reakcji autoimmunologicznych skierowanych przeciwko antygenom tarczycy. Zauważono, że w hamowaniu rozwoju choroby Gravesa duże znaczenie ma stan równowagi pomiędzy populacją komórek T regulatorowych i efektorowych [3,4]. Komórkom T regulatorowym CD4+CD25+Foxp3+ w ostatnich latach poświęca się wiele uwagi w związku z ich korzystnym wpływem na przebieg schorzeń autoimmunologicznych. Stwierdzono m.in., że limfocyty T regulatorowe mogą, za pośrednictwem komórek dendrytycznych (DCs, ang. dendritic cells), hamować aktywację efektorowych limfocytów T oraz wywoływać tolerancję na różnego typu antygeny [5–7]. Wiadomo również, że limfocyty T regulatorowe hamują dojrzewanie DCs, które tylko w formie dojrzałej mogą prawidłowo prezentować antygeny.
Skala problemu skłania do podjęcia badań nad opracowaniem nowych, bardziej efektywnych niż obecnie stosowane, metod leczenia z wykorzystaniem immunoterapii. Zagadnieniem kluczowej wagi dla dalszego rozwoju tej formy terapii wydaje się poznanie czynników, które mogą hamować odpowiedź immunologiczną w trakcie rozwoju choroby o podłożu autoimmunologicznym [1]. W opracowaniu tym omówione zostały zagadnienia dotyczące komórek T regulatorowych i dendrytycznych w patogenezie autoimmunizacyjnej nadczynności tarczycy.
Nadczynność tarczycy
Nadczynność gruczołu tarczowego należy do chorób występujących dość często (ponad 2% populacji). Stwierdza się ją pięciokrotnie częściej
u kobiet niż u mężczyzn. Według badań Kliniki Mayo nowe zachorowania występują w ciągu roku u 45 na 100 tys. osób dorosłych. W Polsce zapadalność na nadczynność tarczycy z powodu choroby Gravesa-Basedowa jest oceniana na około 1 przypadek/25 tys. osób/rok. Schorzenie to pojawia się w różnym wieku, najczęściej jednak w wieku średnim, dzieci chorują ponad 10 razy rzadziej niż dorośli, ale podkreśla się tendencję do wzrostu zachorowalności na autoimmunologiczną nadczynność tarczycy w młodszych grupach wiekowych [1,3]. Nadczynność tarczycy jest najczęściej następstwem nadmiaru obu hormonów tarczycy.
W 10–30% wszystkich przypadków nadczynności gruczołu tarczowego obserwuje się izolowane zwiększenie stężenia T3 (T3-toksykoza). Znacznie rzadziej nadczynność przebiega z izolowanym zwiększeniem stężenia T4 (T4-toksykoza) i prawidłowym stężeniem T3. Ponad 60% wszystkich przypadków nadczynności tarczycy łączy się z występowaniem choroby Gravesa-Basedowa, czyli rozlanego wola toksycznego, u którego podłoża leży proces autoimmunizacyjny. Reakcja autoimmunologiczna jest skierowana głównie przeciwko autoantygenowi, czyli receptorowi TSH w tarczycy [4]. Ujawnienie się jednej z chorób autoimmunologicznych, jaką jest choroba Gravesa-Basedowa, jest sygnałem, że u danego pacjenta mogą w przyszłości ujawnić się objawy innych chorób autoimmunologicznych [3]. Jeśli do tego nie dojdzie, jest duże prawdopodobieństwo, że u tych osób już występują lub będą pojawiać się przeciwciała przeciwko różnym autoantygenom narządowym. Uważa się, że wystąpienie nadczynności tarczycy wiąże się z działaniem trzech grup czynników ryzyka (czynniki genetyczne, środowiskowe oraz zależne od receptora TSH). Czynniki ryzyka genetycznego obejmują defekt genów układu MHC/HLA, w wyniku czego dochodzi do nadmiernego oddziaływania limfocytów T. Tłumaczy się to upośledzeniem aktywności limfocytów T supresorowych, które nie są w stanie zlikwidować klonów limfocytów T, skierowanych przeciwko komórkom gospodarza. Przez indukcję limfocytów B i przekształcenie ich w komórki plazmatyczne, zdolne do produkcji przeciwciał, dochodzi do odpowiedzi humoralnej. Następuje też aktywacja limfocytów cytotoksycznych przeciw antygenom tarczycowym. W chorobie Gravesa-Basedowa, przebiegającej z nadczynnością tarczycy, dominują odczyny typu humoralnego i produkcja różnych klas przeciwciał przeciw receptorowi TSH w tarczycy, zaś w chorobie Hashimoto przeważają reakcje cytotoksyczne [4].
Komórki dendrytyczne w chorobach autoimmunizacyjnych
Komórki dendrytyczne biorą udział w stymulacji odpowiedzi immunologicznej, zapewnieniu tolerancji immunologicznej i z tego względu stały się jednym z głównych obiektów badań nad patogenezą chorób autoimmunologicznych [8]. DCs mają zdolność prezentowania antygenów własnych danego organizmu (autoantygenów) jak i antygenów obcych [9]. Opisano kilka teorii dotyczących udziału DCs w zaburzeniu stanu autotolerancji, wśród których najważniejsze to: zaburzenia równowagi pomiędzy wytwarzaniem cytokin mających wpływ na funkcje komórek dendrytycznych, m.in.: IL-6, TNF-α, INF-α i INF-γ [10] i nieprawidłowa odpowiedź DCs na stymulacje cytokinami, spowodowana zaburzeniami receptorów dla cytokin na ich powierzchni. Uważa się również, że zaburzenia procesu migracji DCs mogą odgrywać rolę w procesie autoagresji [11,12]. W miejscu lokalnego procesu zapalnego o podłożu autoimmunologicznym dochodzi do akumulacji komórek dendrytycznych, co może być spowodowane zwiększoną migracją DCs z krwiobiegu, miejscową generacją DCs z monocytów oraz proliferacją komórek prekursorowych [13]. Badania na zwierzętach udowodniły, że iniekcja zawiesiny komórek dendrytycznych stymulowanych antygenami wywołuje odpowiedź skierowaną przeciw tkankom zawierającym te antygeny, co skutkuje rozwojem choroby z autoagresji.
Funkcje komórek dendrytycznych
Komórki dendrytyczne, współpracując z pozostałymi populacjami komórek układu immunologicznego, stanowią istotny pomost pomiędzy odpornością swoistą i nieswoistą oraz nabytą i wrodzoną. Odgrywają również istotną rolę w tworzeniu tolerancji i pamięci immunologicznej. Do głównych zadań komórek dendrytycznych należą:
Wychwytywanie i pochłanianie antygenu
Jedynie niedojrzałe komórki dendrytyczne mają zdolność wychwytywania i pochłaniania antygenu, a następnie opuszczają swoje środowisko i wędrują w kierunku narządów chłonnych w celu prezentacji antygenu limfocytom [14–16]. Wychwytywanie antygenów może odbyć się na drodze makro-, mikropinocytozy, fagocytozy lub endocytozy zależnej od receptorów [2,15–17].
Przetwarzanie i prezentacja antygenu
Po wychwyceniu i przetworzeniu antygenu komórki dendrytyczne opuszczają tkanki obwodowe i przechodzą do narządów limfatycznych. Podczas procesu dojrzewania i migracji komórki dendrytyczne przekształcają się z komórek wychwytujących i przetwarzających antygeny w komórki prezentujące antygeny komórkom efektorowym [18]. Posiadają one najsilniejsze właściwości prezentacji antygenu. W porównaniu z innymi komórkami prezentującymi antygen, takimi jak makrofagi czy limfocyty B, są one ponad 100 razy bardziej skuteczne w aktywacji limfocytów T. Antygeny egzogenne, pochłonięte na drodze endocytozy, są prezentowane w kontekście cząsteczek MHC klasy II limfocytom T pomocniczym CD4+. Natomiast antygeny pochodzenia endogennego są prezentowane w kontekście MHC klasy I limfocytom cytotoksycznym CD8+ [16,18,19]. Profesjonalne komórki prezentujące antygen, do których należą komórki dendrytyczne, mogą prezentować antygeny zewnątrzpochodne limfocytom T cytotoksycznym w kontekście cząsteczek MHC klasy I [20]. Zjawisko to nosi nazwę cross-priming [21].
Aktywacja limfocytów
Komórki dendrytyczne (profesjonalne komórki prezentujące antygeny) rozpoczynają odpowiedź immunologiczną typu komórkowego, wspomagają rozwój odpowiedzi immunologicznej typu humoralnego oraz wytwarzanie przeciwciał. Uczestniczą również w aktywacji i wspomaganiu funkcji komórek odporności nieswoistej, zapewniają tolerancję immunologiczną [15,22]. Komórki dendrytyczne, jako jedyne z komórek prezentujących antygeny, mają zdolność aktywacji dziewiczych limfocytów T. Dojrzałe DCs, które zaprezentowały pochłonięte na obwodzie antygeny i ukierunkowały rozwój odpowiedzi immunologicznej, pozostają w węzłach chłonnych, ulegając procesowi apoptozy.
Polaryzacja odpowiedzi immunologicznej
Komórki dendrytyczne kontrolują proces polaryzacji aktywowanych limfocytów Th w kierunku Th1 lub Th2, co determinuje powstanie odpowiedniego rodzaju odpowiedzi immunologicznej. Proces ten warunkuje rodzaj komórek dendrytycznych, typ antygenu, profil wydzielanych cytokin oraz wpływ warunków mikrośrodowiska. Pobudzone limfocyty cytotoksyczne CD8+ oraz komórki NK indukują rozwój odpowiedzi komórkowej. Natomiast komórki dendrytyczne wywodzące się z linii limfoidalnej promują odpowiedź typu Th2. Uwalniają one IL-4 oraz IL-10, przez co stymulują limfocyty do wydzielania cytokin z grupy Th2: IL-2, IL-4, IL-5, IL-10. Pobudzone zostają wówczas limfocyty B, które warunkują rozwój odpowiedzi humoralnej [23]. Wpływ na rodzaj indukowanej odpowiedzi ma również stopień dojrzałości komórek dendrytycznych. Uważa się, że niedojrzałe komórki dendrytyczne inicjują odpowiedź Th2, natomiast odpowiedź typu Th1 jest wynikiem oddziaływania limfocytów z dojrzałymi komórkami dendrytycznymi. Uważa się także, że polaryzacja w kierunku Th1 lub Th2 jest uwarunkowana obecnością odpowiednich cząsteczek kostymulujących. Molekuła CD80 (B7-1) promuje powstawanie limfocytów Th1, a molekuła CD86 (B7-2) stymuluje polaryzację w kierunku limfocytów Th2. Komórki dendrytyczne wpływają również na funkcję komórek NK (ang. natural killer cell – naturalna komórka cytotoksyczna), zarówno za pośrednictwem cytokin, jak i przez bezpośrednie interakcje [12]. Komórki dendrytyczne na każdym etapie swego dojrzewania mogą pobudzać proliferację komórek NK oraz wzmagać ich aktywność cytotoksyczną. Dojrzałe komórki regulują aktywność komórek NK przez wytwarzanie IL-12, IL-15, IL-18 [14,2,17]. Komórki dendrytyczne nie tylko dostarczają cytokin pobudzających NK, ale również pełnią ważną rolę w przekazywaniu sygnałów kostymulacyjnych, które uzupełniają aktywację limfocytów NK. Prawidłowe współdziałanie DCs i komórek NK jest konieczne w procesach autoimmunologicznych.
Tolerancja immunologiczna
Komórki dendrytyczne znajdujące się w grasicy biorą udział w negatywnej selekcji limfocytów T, przez co zapewniają tolerancję immunologiczną [24]. Komórki te charakteryzują się wysoką ekspresją cząsteczek układu zgodności tkankowej klasy II oraz CD80, CD83 i CD86. W połączeniu z cząstkami MHC prezentują autoantygeny dojrzewającym limfocytom CD4+ i CD8+. Zbyt swoiste związanie się TCR z kompleksem MHC-antygen powoduje apoptozę autoreaktywnych limfocytów.
Komórki dendrytyczne w nadczynności tarczycy
Niewiele jest badań dotyczących udziału DCs w patogenezie choroby Gravesa-Basedowa. W prawidłowej tarczycy wykrywane są niedojrzałe komórki dendrytyczne, które powstają z monocytów [25]. Po kontakcie z obecnymi w tarczycy antygenami DCs wędrują do narządów limfatycznych, a na ich powierzchni pojawiają się markery dojrzałości [26]. Tarczycowe komórki dendrytyczne zdolne są do indukcji autoimmunizacji na wiele sposobów. Wykazano, że w chorobie Gravesa-Basedowa DCs pozostają w ścisłym kontakcie z komórkami nabłonka tarczycy, podczas gdy u osób zdrowych umiejscowione są w tym narządzie śródmiąższowo [27]. Ponadto u pacjentów cierpiących na chorobę Gravesa-Basedowa zaobserwowano ekspresję markerów dojrzałości na DCs, które prawidłowo nie powinny być obecne [28]. Na modelu zwierzęcym
wykazano, że DCs posiadają zdolność do kontroli funkcji immunosupresyjnej, ekspansji i różnicowania limfocytów regulatorowych, przez co zaangażowane są w patogenezę chorób autoimmunizacyjnych. U pacjentów dodatkowo wykazano, że zaburzenie proporcji mieloidalnych i plazmacytoidalnych DCs prowadzi do zaburzenia funkcji Treg, a dodatkowo plazmacytoidalne DCs poprzez wydzielanie prozapalnych cytokin wiodą do rozwoju choroby Gravesa-Basedowa [42].
Komórki T regulatorowe a autoagresja
Komórki regulatorowe zostały opisane po raz pierwszy jako „supresorowe” limfocyty T w roku 1971 przez Gershona i Kondo, którzy na modelu mysim wykazali ich zdolność do wzbudzania antygenowo-swoistej tolerancji [29]. Komórki T regulatorowe w warunkach fizjologicznych pełnią wiele ważnych funkcji, w tym indukcji tolerancji wobec autoantygenów, co zabezpiecza organizm przed rozwojem autoagresji [5]. Limfocyty regulatorowe stanowią niejednorodną fenotypowo grupę komórek odpowiedzialnych za kontrolę funkcji układu immunologicznego na drodze aktywnej supresji. Funkcjonalnie w obrębie tej populacji można wyróżnić dwie podgrupy komórek.
W pierwszej działanie supresorowe wymaga bezpośredniego kontaktu z komórką docelową i związane jest z molekułami powierzchniowymi (np.: GITR, ang. glucocorticoid-induced tumor necrosis factor receptor, CTLA-4, ang. cytotoxic T lymphocyte antygen 4), natomiast w drugiej, mechanizm działania oparty jest na wydzielaniu cytokin supresyjnych (IL-10, TGF-β, ang. transforming growth factor beta). Od szeregu lat trwają intensywne badania nad licznymi populacjami limfocytów regulatorowych, najwięcej danych dotyczy jednak limfocytów CD4+CD25+ o wysokiej ekspresji cząsteczki CD25 (tzw. CD4+CD25+high), Th3 i Tr1 [30–31]. Zasadniczy mechanizm supresyjnego działania limfocytów CD4+CD25+ opiera się na bezpośrednim oddziaływaniu na komórkę docelową. Po pobudzeniu receptora limfocytów T (T cell receptor –TGR) komórki CD4+CD25+ na drodze aktywnej supresji hamują aktywację i proliferację innych limfocytów [32]. Istnieją także doniesienia mówiące o możliwości pośredniego działania supresyjnego poprzez wpływ na komórki prezentujące antygen bądź poprzez uwalnianie przez komórki CD4+CD25+ cytokin supresyjnych (IL-10) [33]. Wśród najważniejszych molekuł powierzchniowych biorących udział w aktywnej supresji wymieniane są GITR, CTLA-4 oraz TGF-β związane z błoną komórkową [34–35]. Odkrycie regulacyjnych właściwości komórek Treg pozwoliło na częściowe wyjaśnienie ich roli w patogenezie chorób autoimmunizacyjnych, alergicznych, nowotworowych oraz w zjawisku odrzucania przeszczepu. Myszy pozbawione grasicy w ciągu pierwszych dni życia szczególnie narażone były na rozwój narządowo swoistych chorób autoimmunizacyjnych.
Wykazano zmniejszenie odsetka limfocytów CD4+CD25high u pacjentów z chorobami autoimmunizacyjnymi, a także upośledzenie ich zdolności do indukcji autotolerancji [39,40].
Obecnie za naturalnie występujące limfocyty T regulatorowe uznaje się komórki CD4+CD25highFoxp3+, które stanowią około 5–10% wszystkich limfocytów T CD4+ krwi obwodowej [36–38]. Zmniejszony odsetek Treg stwierdzono m.in. u pacjentów z cukrzycą typu I [41,42]. U chorych z łuszczycą, stwardnieniem rozsianym i reumatoidalnym zapaleniem stawów populacja limfocytów Treg CD4+CD25+ cechowała się obniżoną zdolnością do hamowania proliferacji limfocytów efektorowych i wydzielania cytokin w porównaniu z osobami zdrowymi [43–45]. Wobec przedstawionych danych nową formą terapii może stać się zastosowanie limfocytów Treg, gdyż aktywowane limfocyty Treg mogą hamować odpowiedź immunologiczną niezależnie od antygenu [44]. Ze względu na to, iż w przebiegu niektórych chorób autoimmunizacyjnych u człowieka stwierdza się zaburzenie funkcji limfocytów Treg bez zmiany ich odsetka, ewentualna terapia powinna uwzględniać również próby przywrócenia prawidłowej funkcji limfocytów CD4+CD25+ za pomocą środków farmakologicznych bądź też transferu limfocytów Treg od osób zdrowych. Zastosowanie immunosupresji w leczeniu chorób o podłożu autoimmunizacyjnym miało nieoczekiwanie korzystny wpływ na funkcje i liczebność Treg [42–44]. Najnowsze doniesienia wskazują na zwiększenie odsetka limfocytów CD4+CD25+Foxp3+ pod wpływem glikokortykosteroidów w hodowlach komórkowych pozyskanych od osób z chorobą Gravesa-Basedowa in vitro [46].
Limfocyty T regulatorowe w nadczynności tarczycy
W dostępnej literaturze znaleziono niewiele danych na temat populacji komórek T regulatorowych u chorych z nadczynnością tarczycy. Pojedyncze badania wykonane w grupie chorych z chorobami tarczycy o podłożu autoimmunologicznym (chorobą Gravesa-Basedowa oraz zapaleniem tarczycy typu Hashimoto) wykazały mniejszą liczbę komórek T regulatorowych w miąższu tarczycy w porównaniu do ilości tych komórek we krwi obwodowej tych pacjentów oraz w porównaniu do liczby komórek Treg we krwi obwodowej osób z grupy kontrolnej [47]. Badania z użyciem modeli zwierzęcych ujawniły rolę komórek T regulatorowych w hamowaniu antytarczycowej reakcji autoimmunologicznej. Wykazano, że obniżenie ilości komórek regulatorowych sprzyjało nasileniu częstości występowania i zaostrzenia objawów stanu zapalnego tarczycy u zwierząt z eksperymentalnie indukowanym zapaleniem [48].Stwierdzono również, że komórki T regulatorowe zaangażowane są w proces progresji fazy nadczynności tarczycy do niedoczynności tego narządu w trakcie postępującego zapalenia typu Hashimoto [4]. Zauważono, że w rozwoju choroby Gravesa-Basedowa kluczową rolę spełnia zachwianie równowagi pomiędzy populacją komórek T regulatorowych i efektorowych [49]. Autorzy potwierdzili znaczenie subpopulacji komórek T regulatorowych CD8+CD122+, które obok Treg CD4+CD25+high decydują o rozwoju choroby Gravesa-Basedowa u myszy. Ocena ekspresji genu Foxp3, dokonana w grupie pacjentów z chorobą Gravesa-Basedowa oraz zapaleniem tarczycy typu Hashimoto wykazała, że polimorfizm tego genu może odgrywać główną rolę w podatności na autoimmunologiczne schorzenia, zwłaszcza wśród osób rasy kaukaskiej [50].
Interakcje pomiędzy komórkami dendrytycznymi i T regulatorowymi
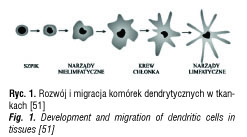
Komórki dendrytyczne są heterogenną populacją leukocytów i charakteryzują się wysokim potencjałem do indukcji pierwotnej odpowiedzi immunologicznej. Ich podstawową funkcją jest pochłanianie i prezentacja antygenów limfocytom T [51]. Komórki dendrytyczne, jako jedyne spośród komórek prezentujących antygen, mają zdolność aktywacji dziewiczych limfocytów T [52]. Odgrywają istotną rolę w regulacji pierwotnej i wtórnej odpowiedzi immunologicznej, jak również w rozwoju tolerancji immunologicznej. Na rycinie 1 przedstawiono główne etapy dojrzewania i wędrówki komórek dendrytycznych [51]. We krwi obwodowej i szpiku ich odsetek nie przekracza 1% komórek. Mają one nieregularny kształt i liczne wypustki błony komórkowej, co zapewnia zwiększoną powierzchnię kontaktu z antygenami i limfocytami [53]. Stwierdzono, że niedojrzałe komórki dendrytyczne w odpowiednich warunkach stymulują wytwarzanie regulatorowych limfocytów T, zarówno CD4+ jak i CD8+, co prowadzi do zwiększonego wydzielania IL-10, cytokiny o działaniu immunosupresyjnym [27, 6]. Indukcję Treg w największym stopniu wzbudzały DCs, których dojrzewanie stymulowano przy pomocy prozapalnych cytokin. Komórki Treg stymulują natomiast ekspresję dioksygenzazy 2,3-indoleaminy (IDO) w komórkach dendrytycznych, enzymu odpowiedzialnego za indukcję tolerancji limfocytów T. W badaniach in vitro wykazano, że komórki dendrytyczne cechujące się ekspresją IDO zamiast stymulacji komórek T posiadają właściwości tolerogenne [54]. Limfocyty Treg wywierają także hamujący wpływ na dojrzewanie komórek dendrytycznych, indukowane pod wpływem komórkowo swoistych ligandów Wykazano, że niedojrzałe DC wywołują tolerancję poprzez anergię lub apoptozę limfocytów T. Jednakże nawet dojrzałe autologiczne DC przy braku egzogennego antygenu mogą indukować proliferację limfocytów T CD4+, wykazujących ekspresję mRNA dla Foxp3 o właściwościach komórek regulatorowych, które wydzielają cytokiny o działaniu immunosupresyjnym, takie jak IL-10 i TGF-β [53]. Ważnym czynnikiem określającym, czy wynikiem interakcji DCs – limfocyt T będzie indukcja odporności, czy immunosupresji za pośrednictwem Treg, jest ekspresja antygenu CD40 na DCs. DCs pozbawione ekspresji tej cząsteczki pod wpływem ekspozycji na antygen indukują rozwój Treg CD4+ wydzielających IL-10, co prowadzi do antygenowo-swoistej tolerancji [55].
Limfocyty regulatorowe mogą za pośrednictwem receptora CTLA-4 kontaktować się z komórkami dendrytycznymi, wiążąc cząsteczki CD80 i CD86. W wyniku takiego połączenia w komórkach dendrytycznych uaktywnione zostaje wytwarzanie IDO (ang. indoleamine 2,3-dioxygenase) – enzymu, który bierze udział w metabolizmie tryptofanu. Skutkiem takich przemian biochemicznych jest usunięcie tryptofanu z otaczającego środowiska, czego wynikiem jest wzbudzenie właściwości tolerogennych komórek dendrytycznych [6,7,56].
Podsumowanie
Badania ostatnich kilku lat potwierdziły ważną rolę komórek T regulatorowych w rozwoju schorzeń z autoagresji, w tym tarczycy. Wydaje się, że pełne poznanie i zrozumienie mechanizmów działania tych komórek w istotny sposób wyjaśniłoby mechanizm kontroli aktywności układu immunologicznego, a farmakologiczna bądź immunologiczna modyfikacja ich funkcji mogłaby w przyszłości posłużyć jako forma immunoterapii. W świetle przedstawionych danych dokładne poznanie zależności między limfocytami T regulatorowymi a komórkami dendrytycznymi i efektorowymi wydaje się mieć kluczowe znaczenie dla rozwoju immunoterapii. Należy sądzić, że zwiększenie populacji i stymulacja funkcji limfocytów T regulatorowych u chorych z nadczynnością tarczycy może w istotny sposób wpłynąć na poprawę wyników leczenia.
Piśmiennictwo
1. Drexhage H.A.; Przegląd autoimmunologicznych schorzeń tarczycy. Thyroid International; Merck 1995:4, 8
2. Jonuleit H, Schmitt E.; The regulatory T cell family: distinct subsets and the interrelations; J. Immunol. 2003:15, 171(12), 6323-6327
3. Nauman J., Nauman A.; Choroba Gravesa; etiopatogeneza, klinika, leczenie; Endokrynol. Pol.- Polish J. Endocrinol. 1995:46, 3-8
4. McLachlan S.M., Nagayama Y., Pichurin P.N. et al.; The link between Graves’ disease and Hashimoto’s thyroiditis: a role for regulatory T cells; Endocrinology 2007:148(12), 5724-5733
5. Maloy K.J., Powrie F.; Regulatory T cells in the control of immune pathology; Nat. Immunol. 2001 Sep:2(9), 816-822
6. Wojas J., Pajtasz-Piasecka E.; Oddziaływanie komórek dendrytycznych z limfocytami T regulatorowymi; Post. Hig. Med. Dośw. 2010:64, 167-174
7. Kushwah R., Hu J.; Role of dendritic cells in the induction of regulatory T cells; Cell and Biosciences 2011:1, 20
8. Turley S.J.; Dendritic cells: inciting and inhibiting autoimmunity; Curr. Opin. Immunol. 2002:14(6), 765-770
9. Watts C., Amigorena S.; Phagocytosis and antigen presentation; Semin. Immunol. 2001:13, 373-379. Immunol., 2002:14(6), 765-770
10. Ardavin C., Martinez del Hoyo G., Martin P. et al.; Origin and differentiation of dendritic cells; Trends in Immunology 2001:22, 691-700
11. Cravens P.D., Lipsky P.E.; Dendritic cells, chemokine receptors and autoimmune inflammatory diseases; Immunol. Cell. Biol. 2002:80(5), 497-505
12. Drakesmith H., Chain B., Beverley P.; How can dendritic cells cause autoimmune disease; Immunology Today 2000:vol. 21, 214-217
13. Tabarkiewicz J., Wojas K., Roliński J. et al.; BDCA-1 positive and BDCA-2 positive dendritic cells – comparison between peripheral blood and the inflammatory synovial fluid in children with Juvenile Idiopathic Arthritis; Ann. UMCS Sect. D 2003:vol 58, supl., 67-73
14. Banchereau J., Briere F., Caux C.; Immunobiology of Dendritic Cells; Annu. Rev. Immunol. 2000:18, 767-811
15. Dzionek A., Inagaki Y., Okawa K. et al.; Plasmacytoid Dendritic cells: from specific surface markers to specific cellular functions; Human Immunology 2002:63, 1133-1148
16. Dzionek A., Fuchs A., Schmidt P. et al.; BDCA-2, BDCA-3, and BDCA-4: three markers for distinct subsets of dendritic cells in human peripheral blood; J. Immunol. 2000:165: 6037-6046
17. Lotze M.T., Thomson A.W.; Dendritic Cells. Second Edtition; Academic Press 2001
18. Thery C., Amigorena S.; The cell biology of antigen presentation in dendritic cells; Curr. Opin. Immunol. 2001:13, 45-51
19. Avigan D.; Dendritic cells: development, function and potential use for cancer immunotherapy; Blood Rev. 1999:13, 51-64
20. Fonteneau J.F., Kavanagh D.G., Lirvall M. et al.; Characterization of the MHC class I cross-presentation pathway for cellassociated antigens by human dendritic cells; Blood 2003:102, 4448-4455
21. Bevan M.J.; Minor H antigens introduced on H-2 different stimulating cells cross-react at the cytotoxic T cell level during in vivo priming; J. Immunol. 1976:117, 2233-2238
22. Garderet L., Cao H., Salamero J. et al.; In vitro production of dendritic cells from human blood monocytes for therapeutic use; J. of Hematotherapy & Stem Cell Research. 2001:10, 553-567
23. Pirtskhalaishvili G., Shurin G.V., Gambotto A et al.; Transduction of dendritic cells with Bcl-xL increases their resistance to prostate cancer-induced apoptosis and antitumor effect in mice; J. Immunol. 2000:165, 1956-1964
24. Hart D.N.J.; Dendritic Cells: Unique Leukocyte Populations Which Control the Primary Immune Response; Blood. 1997:90, 3245-3287
25. Peters J.H., Gieseler R., Thiele B., Steinbach F.; Dendritic cells: from ontogenetic orphans to myelomonocytic descendants; Immunol Today 1996:17, 273-278
26. Strobl H., Riedl E., Bello-Fernandez M.-C., Knapp W.; Epidermal Langerhans cell development and differentiation; Immunobiology 1998:198, 588-605
27. Mölne J., Jansson S., Ericson L.E., Nilsson M.; Adherence of RFD-1 positive dendritic cells to the basal surface of thyroid follicular cells in Graves’ disease; Autoimmunity 1994:17, 59-71
28. Mölne J., Jansson S., Ericson L.E., Nilsson M.; Adherence of RFD-1 positive dendritic cells to the basal surface of thyroid follicular cells in Graves’ disease; Autoimmunity 1994:17, 59-71
29. Godfrey D., Kronenberg M.; Going both ways: Immune regulation via CD1d-dependent NKT cells; J. Clin. Inves. 2004:114, 1379-1388
30. Holm T., Nielsen J., Claesson M.; CD4CD25 regulatory T cells: Phenotype and physiology; APMIS: Acta Pathologica, Microbiologica et Immunologica Scandinavia 2004:112, 629-641
31. Boehmer von H.; Mechanisms of suppression by suppressor T cells; Nature Immunology 2005 Apr:6(4), 338-344
32. Asseman C., Mauze S., Leach M. et al.; An essential role for interleukin10 in the function of regulatory T cells that inhibit intestinal inflammation; Journal of Experimental Medicine 1999:190, 995-1004
33. Nakamura K., Kitani A., Strober W.; Cell contact- dependent immunosuppression by CD4(+)CD25(+) regulatory T- cells is Mediatel by cell surface- bound trans forming growth- factor beta; Journal of Experimental Medicine 2001:194, 629-644
34. Shi H., Qin X.; CD4 CD25 regulatory T lymphocytes In allergy and astma; Allergy 2005, 986-995
35. Mantel P.Y., Quaked N., Ruckert B.I. et al.; Molecular mechanisms underlying Foxp3 induction in human T cells; Journal of Immunology 2006:176, 3593-3602
36. Baratelli F., Lin Y., Zhu L. et al.; Prostaglandin E2 induces FOXP3 gene expression and T regulatory cell function in human CD4+ T cells; J. Immunol. 2005:175(3), 1483-90
37. Hontsu S., Yoneyama H., Ueha S. et al.; Visualization of naturally occurring Foxp3+ regulatory T cells in normal and tumor-bearing mice; Int. Immunopharmacol. 2004:4(14), 1785-1793
38. Liu M.F., Wang C.R., Fung L.L., Wu C.R.; Decreased CD4+CD25+ T cells in peripheral blood of patients with systemic lupus erythematosus; Scand. J. Immunol. 2004:59(2), 198-202
39. Shevach E.M.; Regulatory T cells in autoimmunity; Annu Rev. Immunol. 2000:18, 423-449
40. Kukreja A., Cost G., Marker J., Zhang C. et al.; Multiple immuno-regulatory defects in type-1 diabetes; J. Clin. Invest. 2002:109, 131-140
41. Lewkowicz P., Lewkowicz N., Tchórzewski H.; CD4+CD25+ T regulatory cells in pathophysiology and therapy of immunologic diseases; Post. Hig. Med. Dosw. 2005:59, 371-376
42. Ehrenstein M.R., Evans J.G., Singh A. et al.; Compromised function of regulatory T cells in rheumatoid arthritis and reversal by anti-TNFa therapy; J. Exp. Med. 2004:200, 277-285
43. Horwitz D.A., Zheng S.G., Gray J.D. et al.; Regulatory T cells generated ex vivo as an approach for the therapy of autoimmune disease; Semin. Immunol. 2004:16, 135-143
44. Putheti P., Morris M., Stawiarz L. et al.; Multiple sclerosis: a study of chemokine receptors and regulatory T cells in relation to MRI variables; Eur. J. Neurol. 2003:10, 529-535
45. Mao C., Wang S., Xiao Y., Xu J., Jiang Q. et al.; Impairment of regulatory capacity of CD4+CD25+ regulatory T cells mediated by dendritic cell polarization and hyperthyroidism in Graves’ disease; J. Immunol. 2011:15, 186(8), 4734-4743
46. Nakano A., Watanabe M., Iida T. et al.; Apoptosis- induced Decrease of Intrathyroidal AD4(+)CD25(+) Regulatory T Cells in Autoimmune Thyroid Diseases; Thyroid 2007:1, 25-31
47. Kong Y.C., Flynn J.C., Banga J.P. et al.; Application of HLA class II transgenic mice to study autoimmune regulation; Thyroid 2007:17(10), 995-1003
48. Saitoh O., Abiru N., Nakahara M.; CD8+CD122+ T cells, a newly identified regulatory T subset, negatively regulate Graves’ hyperthyroidism In a Marine model; Endocrinology 2007:148(12), 6040-6046
49. Ban Y., Tozaki T., Tobe T. et al.; The regulatory T cell gene FOXP3 and genetic susceptibility to thyroid autoimmunity: an association analysis in Caucasian and Japanese cohorts; Journal Autoimmun 2007:28(4), 201-207
50. Jakóbisiak M., Gołab J.; Prezentacja antygenów limfocytom T. W: Immunologia. (red. J. Gołąb, M. Jakóbisiak, W. Lasek); Wydawnictwo Naukowe PWN 2002, 157-175
51. Banchereau J., Steinman R.M.; Dendritic cells and the control of immunity; Nature 1998:392, 245-252
52. Mazur G., Prażuch M., Wróbel T. et al.; Komórki dendrytyczne zastosowanie w immunoterapii nowotworów; Onkol. Pol. 2001:4, 3-4, 141-145
53. Adams S., O’Neill D.W., Bhardwaj N.; Recent advances in dendritic cell biology; J. Clin. Immunol. 2005:25(3), 177-188
54. Seroogy C., Gern J.; The role of T regulatory cells in astma; Journal of Allergy and Clinical Immunology 2005:116, 996-999
55. Munn D.H., Mellor A.L.; IDO expression by dendritic cells: tolerance and tryptophan catabolism; Nat. Rev. Immunol. 2004:4, 762-774
56. Zou W.; Regulatory T cells, tumour immunity and immunotherapy; Nature 2006:6, 295-307








