Endokrynol. Ped. 11/2012;4(41):57-64
DOI: 10.18544/EP-01.11.04.1429
Zastosowanie Kwestionariusza Samopoczucia Dziecka Leczonego Hormonem Wzrostu do badania dzieci z somatotropinową niedoczynnościa przysadki podczas terapii rekombinowanym ludzkim hormonem wzrostu
Katedra Auksologii Klinicznej i Pielęgniarstwa Pediatrycznego Wydział Nauk o Zdrowiu Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Słowa kluczowe: niskorosłość, dzieci, jakość życia, ludzki rekombinowanym hormon wzrostu
Streszczenie
Celem pracy jest przedstawienie wyników badań dotyczących jakości życia (QoL) dzieci z somatotropinową niedoczynnościa przysadki (SNP) przed i w trakcie terapii ludzkim rekombinowanym hormonem wzrostu (rhGH). Badaniem objęto dzieci z SNP leczone w Poradni Endokrynologicznej Szpitala Klinicznego im. Karola Jonschera Uniwersytetu Medycznego w Poznaniu. Do oceny jakości życia niskorosłych pacjentów użyto Kwestionariusza Samopoczucia Dziecka Leczonego Hormonem Wzrostu. Wyniki. W badaniu dowiedziono, iż terapia rhGH poprawia w sposób istotny jakość życia dzieci z SNP. Istotną poprawę jakości życia podczas leczenia obserwowano zwłaszcza przez pierwsze półrocze terapii. Spowolnienie tempa wzrastania, prowadzące do niedoboru wzrostu, należy do dominujących objawów somatotropinowej niedoczynności przysadki u dzieci i młodzieży. Zastosowanie leczenia substytucyjnego preparatem rhGH pozwala osiągnąć dzieciom z SNP wzrost ostateczny jak najbardziej zbliżony do wzrostu prawidłowego. Niskorosłość jest czynnikiem negatywnie wpływającym na jakość życia. Dzieci wyróżniające się najniższym wzrostem w grupie rówieśniczej cierpią na brak akceptacji, odrzucenie i osamotnienie, co może prowadzić do zaburzeń w rozwoju emocjonalnym i społecznym. W trwających od wielu lat badaniach dowiedziono, że jakość życia dorosłych pacjentów z SNP poddanych terapii rhGH ulega znacznej poprawie. Nie obserwuje się u nich efektu wzrostowego, natomiast chorzy ci zgłaszają znacząca poprawę samopoczucia, napędu życiowego, obserwuje się u nich poprawę funkcji poznawczych oraz sprawności intelektualnej
Wstęp
Dzieci z niedoborem wzrostu narażone są na wiele negatywnych doświadczeń emocjonalnych w relacjach społecznych, zarówno w kontaktach z rówieśnikami, jak i z dorosłymi. Niedobór wzrostu może prowadzić do deprywacji emocjonalnej w okresie dzieciństwa, czego skutki rzutują na cały dalszy rozwój i późniejsze życie. Problem zbyt niskiego wzrostu może powodować nieodwracalne szkody w psychice dziecka, wpływając także na pogorszenie jakości życia. Szybkie zdiagnozowanie przyczyny zaburzeń wzrastania oraz niezwłoczne leczenie niedoboru wzrostu ma istotne znaczenie, wynikające nie tylko z potrzeb fizycznych, ale także ze sfery emocjonalnej i psychicznej.
Wzrastanie człowieka jest wypadkową złożonych procesów biologiczno-chemicznych, które warunkują proporcjonalny rozwój organizmu. Osiągany wzrost jest „zaprogramowany” genetycznie, ale zależy też od wielu czynników, których działaniu jest poddawany organizm w okresie wzrastania. Istotne jest prawidłowe odżywianie – odpowiednio zbilansowana dla wieku dieta, duże znaczenia odgrywają też wpływy środowiskowe, kulturowe, emocjonalne oraz narażenie na czynniki infekcyjne.
Kluczową rolę w procesie wzrastania odgrywa układ hormonalny. W okresie płodowym przeważa działanie IGF-I i –II (insulin-like growth factor-I, II), insuliny oraz hormonów tarczycy. Natomiast po urodzeniu zaczyna dominować hormon wzrostu.
Somatotropinowa niedoczynność przysadki
Problem niedoboru wzrostu dotyka około 3% populacji. U pacjentów ze wzrostem poniżej 3 c. (lub 2 odchylenia standardowe po uwzględnieniu wzrostu rodzicielskiego), rosnących poniżej 4 cm w skali roku, u których stwierdza się opóźnienie wieku kostnego o co najmniej 2 lata, należy jako przyczynę podejrzewać deficyt hormonu wzrostu (somatotropinowa niedoczynność przysadki, SNP). Występowanie SNP określa się na 1/4000–1/10000 urodzeń [1]. Etiologia jest bardzo zróżnicowana – u ¼ dzieci stwierdza się obecność zmian organicznych w okolicy podwzgórzowo-przysadkowej (guz, stan po urazie, zmiany zapalne, lub wady anatomiczne). Najczęściej jednak mamy do czynienia z SNP idiopatyczną [2].
Leczenie hormonem wzrostu
W procesie kwalifikacji do leczenia ludzkim rekombinowanym hormonem wzrostu uwzględnia się parametry auksologiczne (wzrost, szybkość wzrastania oraz zaawansowanie wieku kostnego [3]) i laboratoryjne: stwierdzenie niedoboru GH i obniżone stężenie IGF-I [4]. W Polsce u około 200 tys. dzieci rocznie rozpoznaje się zaburzenia wzrastania, z czego 1,5 % powodowane jest zaburzeniami w uwalnaniu hormonu wzrostu [5].
Obecnie wskazaniami do zastosowania terapii rhGH u dzieci są: somatotropinowa lub wielohormonalna niedoczynność przysadki, zespół Turnera, niedobór wzrostu w przebiegu przewlekłej niewydolności nerek oraz zespół Prader-Willy [6]. Preparat rhGH stosowany jest w codziennych injekcjach podskórnych, w dawce obliczanej wg masy ciała. Wskazaniem do zaprzestania terapii jest osiągnięcie przez dziecko wzrostu docelowego lub zakończenie procesu wzrastania [7–9].
Badania nad jakością życia
Pojęcie jakości życia (Quality of life, QoL) dotyczy możliwości realizowania wytyczonych celów życiowych, pełnienia określonych ról społecznych, wpływu czynników społeczno-demograficznych na nasze życie. W ostatnich latach wielu badaczy podejmuje tematy dotyczące jakości życia w chorobach przewlekłych; projekty te najczęściej dotyczą pacjentów dorosłych. Wydaje się, że zajęcie się tym problemem już w wieku rozwojowym ma ogromne znaczenie z uwagi na to, iż wczesne określenie potrzeb dziecka oraz identyfikacja czynników działających negatywnie pozwalają na podejmowanie prób eliminowania zagrożeń i tym samym wpływanie na poprawę jakości życia w latach późniejszych.
W badaniach naukowych mają zastosowanie różnego rodzaju instrumenty pomiaru jakości życia, a uzyskane za ich pomocą dane (patient reported outcomes) stanowią ważną część informacji potrzebnych do określenia skuteczności oraz bezpieczeństwa nowych terapii. Największa wartość mają dane uzyskiwane w trakcie badań, z wykorzystaniem narzędzi specyficznych dla danej jednostki chorobowej, uwzględniające spodziewane objawy, problemy oraz ich oddziaływanie na codzienną aktywność, funkcjonowanie w grupie rówieśniczej, szkole, rodzinie.
Metody i narzędzia badawcze
Badaniem objęto grupę 41 dzieci obu płci, w wieku 6–18 lat, z SNP, leczonych rhGH w Poradni Endokrynologicznej Szpitala Klinicznego im. Karola Jonschera w Poznaniu w latach 2006–2010. Badanie prowadzono w formie sondażu diagnostycznego z użyciem techniki ankietowej. Do oceny jakości życia chorych użyto Kwestionariusza Samopoczucia Dziecka Leczonego Hormonem Wzrostu w wersjach dla dziecka KSDLHW-CF20 i rodzica KSDLHW-PF24. Zmiany jakości życia oceniano przez porównanie danych uzyskanych przed rozpoczęciem leczenia rhGH po 6 i po 12 miesiącach terapii. Uzyskane dane poddano analizie statystycznej.
Specyficzność użytego kwestionariusza odnosi się zarówno do choroby (HRQoL i jej zmiany związane z leczeniem w grupie badanej, tj. u pacjentów z SNP leczonych rhGH), jak i do populacji (dzieci i młodzieży). Szczegółowo są w nim oceniane określone aspekty funkcjonowania dziecka oraz konkretne problemy, na które wpływ może mieć choroba i leczenie, na przykład ból i uciążliwość terapii rhGH. Jednocześnie spełniony został warunek zachowania logiki, zrozumienia sensu pytań kierowanych do badanego pacjenta, którym było małe dziecko i opiekun. Kwestionariusze zostały tak skonstruowane, że większość pytań w nich zawartych dotyczy zjawisk, które u danego chorego mogą ze znacznym prawdopodobieństwem wystąpić w przebiegu choroby i zastosowanego leczenia. Ponadto rodzice pacjentów w pytaniach otwartych mieli możliwość wskazania największych problemów, z którymi według nich boryka się dziecko. Sami pacjenci także mieli możliwość opisowo przedstawić swoje główne problemy i dolegliwości.
Czy jakoś życia zależy od leczenia rekombinowanym ludzkim hormonem wzrostu? Odpowiedzi na pytania z kwestionariuszy zostały przekształcone na wartości liczbowe z przedziału od 15 do 73 oraz od 19 do 115 odpowiednio dla KSDLHW-CF20 i KSDLHW-PF24. Wyższe wartości oznaczają lepszą jakość życia (rozumianą jako Helth Related QoL).
Wyniki
Wpływ leczenia na zbiorczą wartość liczbową w skalach kwestionariuszy został zbadany przez porównanie rozkładów wartości w kolejnych momentach badania, tj. przed leczeniem (t1), po 6 miesiącach (t2) oraz po roku leczenia (t3). Na podstawie danych z kwestionariuszy w każdym z trzech momentów badania wyznaczono statystyki opisowe (tabele I i II) oraz przedstawiono je w formie graficznej (ryciny 1 i 2).
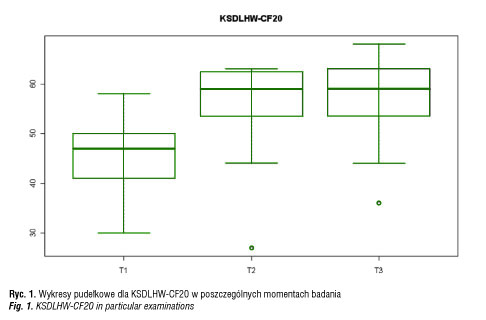
Mediana dla KSDLHW-CF20 w momencie badania t1 była równa 47, co oznacza, że w 50% przypadków uzyskano zbiorczą wartość liczbową co najmniej równą 47, a w pozostałych przypadkach poniżej 47. Po pół roku (t2) i po roku leczenia (t3) mediana była równa 59. Średnia wartość uzyskana w KSDLHW-CF20 w momencie t1 była równa 44,43. Leczenie wpłynęło na poprawę wartości średniej – w momencie t2 średnia była równa 56,5, natomiast w momencie badania t3 średnia była równa 57,9.

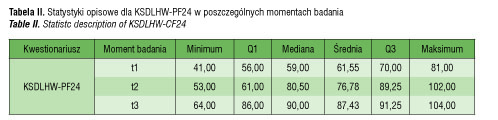

Mediana dla KSDLHW-PF24 w momencie badania t1 była równa 59, co oznacza, że w 50% przypadków uzyskano zbiorczą wartość liczbową co najmniej równą 59, a w pozostałych przypadkach poniżej 59. Po pół roku (t2) mediana była równa 80,5, a po roku leczenia (t3) wyniosła 90. Średnia wartość uzyskana w KSDLHW-PF24 w momencie t1 była równa 61,55. Leczenie wpłynęło na poprawę wartości średniej – w momencie t2 średnia była równa 76,78, natomiast w momencie badania t3 średnia była równa 87,43.
Otrzymane wyniki wskazują na poprawę zbiorczej wartości wskaźnika samopoczucia w trakcie leczenia w skalach podsumowujących KSDLHW-CF20 i KSDLHW-PF24. Największa poprawa zauważalna jest po pierwszych 6 miesiącach leczenia. Kolejne pół roku leczenia nie różnicuje tak znacząco wyników. Średnia wartość wskaźnika samopoczucia po pół roku leczenia wzrosła o ponad 12 jednostek dla skali kwestionariusza KSDLHW-CF20, a według skali kwestionariusza KSDLHW-PF24 wzrosła o ponad 15 jednostek. Po kolejnych 6 miesiącach średnia wartość w tych skalach wzrosła odpowiednio o 1,4 i około 9 jednostek. Podobnie było z pozostałymi miarami rozkładu. Po pół roku widoczna była duża poprawa, natomiast po roku wartości nie zmieniają się tak znacząco.
Przeprowadzone zostały testy badające istotność statystyczną wpływu leczenia na wartość skali podsumowującej samopoczucie dziecka. W teście Kruskala Wallisa wartość p dla kwestionariusza KSDLHW-CF20 była równa 0.000000000002, natomiast dla kwestionariusza KSDLHW-PF24 była równa 0.000000000000007. W obu przypadkach przy bardzo niskich poziomach istotności należało przyjąć za udowodnioną hipotezę o znamiennym wpływie leczenia na samopoczucie dziecka, oceniane przez rodzica i przez nie same.
Zbadane zostało, czy wzrost wskaźnika samopoczucia (zbiorczej wartości liczbowej w skalach tych kwestionariuszy) pomiędzy jednym momentem badania a kolejnym był statystycznie istotny. Przeprowadzone testy Wilcoxona określały, czy wartość zbiorcza wynikająca z odpowiedzi na pytania kwestionariusza udzielone w momencie t2 była statystycznie istotnie większa od wartości z momentu t1, czy w momencie t3 wartość ta była istotnie większa od wartości z momentu t1, a także czy zmiana wartości (poprawa) w momencie t3 w porównaniu do momentu t2 była istotna. W tabeli III zostały zebrane wartości p dla odpowiednich testów. We wszystkich przypadkach na poziomie istotności mniejszym od 0.05 potwierdzono hipotezę o istotnym wzroście wartości wskaźnika samopoczucia podczas leczenia. Największy wpływ na poprawę samopoczucia nastąpił przez pierwsze pół roku leczenia.
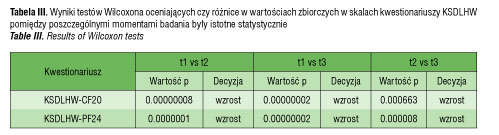
Widać, że wartości p dla różnic pomiędzy momentami badania t2 i t3 są stosunkowo największe. Wyniki te potwierdzają wcześniej zaobserwowane tendencje statystyk opisowych. Pacjenci i opiekunowie niechętnie wykorzystywali możliwość opisowego omówienia swoich dolegliwości i problemów. Tylko 14% oddanych kwestionariuszy zawierało zapełnione pole „największy problem”. U wszystkich badanych, którzy wykorzystali możliwość odpowiedzi na pytania opisowe, pojawiła się ta sama odpowiedz: największy problem to niski wzrost dziecka, poza tym wskazywano też na brak akceptacji wśród rówieśników, nieśmiałość. Nikt z badanych nie uznał za problematyczne, bolesne czy uciążliwe wykonywanie codziennych iniekcji.
Omówienie i dyskusja
Istnieją tylko nieliczne doniesienia o próbach podejmowania oceny QoL u dzieci z zaburzeniami wzrastania. Koncentrowały się one głównie na stanie psychologicznym. Stosunkowo mało prac skupiało się na ocenie QoL, co sprawia, że jest to zagadnienie wciąż słabo poznane [10,11].
Istotny problem stanowią narzędzia pomiarowe. To, że stosunkowo niedawno zainteresowano się tematem jakości życia niskorosłych dzieci, powoduje, że prowadzone obecnie badania dopiero próbują znaleźć odpowiednie narzędzia do oceny QoL. Nie dało się w sposób prosty przenieść metod stosowanych u dorosłych na populację rozwojową. Wydaje się, że dużą rolę odgrywa tu inna w wieku dorosłym hierarchizacja potrzeb. Bardzo ważne jest też dobranie odpowiedniej, jednorodnej grupy badanej.
Obecnie na świecie wciąż trwają badania mające na celu stworzenie specyficznego kwestionariusza, który służyłby obserwacji dzieci z zaburzeniami wzrastania oraz dzieci leczonych hormonem wzrostu. Zaplanowana w pracy ocena HRQoL wymagała użycia narzędzia bardziej specyficznego, którego dotychczas nie było. Na podstawie danych literatury, przeglądając liczne badania z zastosowaniem kwestionariuszy służących do oceny jakości życia zarówno dorosłych, jak i dzieci, stwierdzono, że brakuje odpowiedniego narzędzia do badań dzieci z SNP. Kwestionariusze stosowane u pacjentów dorosłych, ze względu na swoją specyfikę – pytania dotyczące procesu edukacji, kariery zawodowej, możliwości tworzenia relacji partnerskich, seksualności, w końcu możliwości zakładania rodziny – nie nadają się do zastosowania u chorych w wieku rozwojowym. Nieliczne kwestionariusze, które stosowano dotychczas w badaniach na grupie dziecięcej, były albo kwestionariuszami niespecyficznymi, generycznymi, albo nie przeszły procesu walidacyjnego, co uniemożliwiało zastosowanie ich w obecnym projekcie [12–14]. Konieczne było więc stworzenie takiego narzędzia badawczego, które uwzględniałoby specyfikę jednostki chorobowej, jaką jest SNP, oraz byłoby odpowiednie do badania populacji dziecięcej w Polsce. Przy tworzeniu pytań korzystano z opracowań dotyczących najczęściej stosowanych kwestionariuszy w badaniach QoL dzieci i dorosłych [12–17]. Przy ostatecznym formułowaniu pytań (zwracając szczególna uwagę na logikę i zrozumienie pytań przez najmłodszych pacjentów – już w wieku od 6 lat) konsultowano się z psychologiem klinicznym z Uniwersytetu im. Adama Mickiewicza w Poznaniu. Oparto się także na informacjach i doświadczeniach pacjentów i rodziców dzieci, które od kilku lat są leczone rhGH. Tak powstał Kwestionariusz Samopoczucia Dziecka Leczonego Hormonem Wzrostu (KSDLHW).
Tworząc ten kwestionariusz, kierowano się zasadami pozwalającymi na nadanie mu cech narzędzia specyficznego. Kwestionariusz przeznaczony jest dla bardzo konkretnej populacji i służy do oceny QoL pacjentów z określonym rozpoznaniem klinicznym, uwzględniając objawy i przebieg choroby. Jako swoisty dla jednej tylko jednostki chorobowej, kwestionariusz ma mały zakres ewaluacyjny, tzn. nie jest przeznaczony do badań porównawczych między populacjami chorych na różne choroby. Ponieważ miał on oceniać zmiany zachodzące pod wpływem leczenia, przy jego opracowywaniu dążono do tego, aby był trafny (ang. longitudinal validity) i wrażliwy (ang. responsive), czyli zdolny do wykrycia małych, ale potencjalnie istotnych dla pacjenta zmian. Zastosowane w badaniach opisywanych w niniejszej pracy Kwestionariusze Samopoczucia Dziecka Leczonego Hormonem Wzrostu okazały się instrumentem bardzo wrażliwym na ważne z punktu widzenia uczestników badania zmiany QoL, które zachodziły w trakcie terapii rhGH.
Z przeprowadzonych badań własnych wynika, że terapia rekombinowanym ludzkim hormonem wzrostu w istotny sposób zmienia jakość życia dzieci z somatotropinową niedoczynnością przysadki. Wnioski takie wyciągnięto po analizie wyników testów statystycznych przeprowadzonych na danych uzyskanych zarówno z kwestionariusza wypełnianego przez chore dzieci, jak i z kwestionariusza wypełnianego przez ich rodziców lub opiekunów.
Leczenie rhGH w przypadku stosowania dawek substytucyjnych jest uważane za bezpieczne [18]. W badaniach u dorosłych pacjentów prowadzonych nad bezpieczeństwem terapii ludzkim rekombinowanym hormonem wzrostu najczęściej opisywanymi objawami niepożądanymi są bóle stawowe i mięśniowe, obrzęki i zespół cieśni nadgarstka [19,20]. Powikłania tego rodzaju stwierdza się u około 10–17% leczonych, przy czym bardziej zagrożeni ich wystąpieniem są chorzy otyli i ci, u których wystąpił niedobór GH o późnym początku [22]. Wymienione objawy bywają następstwem stosowania zbyt dużych dawek GH. Dawkowanie hormonu, zapewniające jego stężenia w zakresie wartości fizjologicznych, nie wiąże się z reguły z ich wystąpieniem [21,22]. Objawy niepożądane najczęściej opisywane u dzieci to przejściowe zwiększenie ciśnienia śródczaszkowego, złuszczenie głowy kości udowej, boczne skrzywienie kręgosłupa, ginekomastia i częstsze występowanie mialgii [23]. Są one jednak obserwowane bardzo rzadko [24–26]. W materiale badań własnych nie stwierdzono żadnego takiego przypadku.
Na podstawie przeprowadzonych badań udało się wykazać znamienny fakt, że efekt poprawy jakości życia jest o wiele wyraźniejszy na przestrzeni pierwszych sześciu miesięcy od rozpoczęcia leczenia rhGH. Po drugim półroczu leczenia wskaźniki jakości życia nie poprawiają się już w tak znaczącym stopniu. Może to wynikać ze stosunkowo dużych oczekiwań zarówno dzieci, jak i rodziców, dotyczących skutków podjętego leczenia. Z czasem pozytywne emocje i nadzieje związane z rozpoczęciem cyklu leczenia ustąpić mogły uczuciom zniechęcenia z powodu mniej spektakularnych, niż się spodziewano, efektów wzrostowych oraz uciążliwości regularnych iniekcji. Trzeba zauważyć, że to właśnie zaraz po rozpoczęciu terapii rhGH występuje zjawisko catch up (nadganiania zaległości) [27,28], a więc etap leczenia, w którym uzyskuje się najlepsze efekty dotyczące zwłaszcza szybkości wzrastania. Czas trwania tego zjawiska jest różnie określany, szacuje się, że trwa od kilku miesięcy do jednego roku [29,30]. Wydaje się, że może to stanowić wytłumaczenie faktu poprawy oceny jakości życia, jaka zachodzi właśnie w tym czasie (od t1 do t2). Nie bez znaczenia jest także efekt psychologiczny. Chory rozpoczyna leczenie, co daje mu perspektywę poprawy stanu zdrowia – uzyskania wyższego wzrostu. To, że efekt leczenia w odniesieniu do jakości życia jest najbardziej widoczny w pierwszych miesiącach terapii, potwierdza tylko wysokie oczekiwania dzieci oraz rodziców co do skuteczności leczenia rhGH. Okres po wdrożeniu leczenia pozwala na uspokojenie sumienia rodziców, ich dziecko „jest leczone, a więc na pewno będzie wyleczone”.
Uzyskane wyniki wskazują na konieczność prowadzenia tego typu badań w trakcie terapii rhGH chorych z SNP. Pozwoli to na poprawę opieki nad tymi pacjentami. Na szczególną uwagę zasługuje konieczność objęcia pacjenta opieką psychologiczną, zwłaszcza w okresie leczenia powyżej 3–6 miesięcy, z powodu zmniejszonej satysfakcji z efektu wzrostowego, która występuje po tym okresie leczenia.
Należy także kontynuować tego typu badania w grupie chorych z SNP, aby określić długoterminowe wpływy terapii na jakość życia pacjentów w trakcie dalszego leczenia oraz po jego zakończeniu. Uzyskane wyniki dość wyraźnie sugerują również potrzebę prowadzenia terapii rhGH u chorych w wieku dorosłym, u tych pacjentów, którzy wykazują przetrwały niedobór GH, choćby ze względu na pogorszenie jakości ich życia po osiągnięciu wzrostu ostatecznego.
Ważne dla planowania następnych badań byłoby uwzględnienie oceny QoL przed leczeniem, w trakcie terapii i po osiągnięciu wzrostu ostatecznego.
Wnioski
Terapia rekombinowanym ludzkim hormonem wzrostu (rhGH) zmienia w sposób istotny jakość życia (QoL) dzieci z somatotropinową niedoczynnością przysadki (SNP). Wyniki uzyskane z analizy danych kwestionariuszy wskazują wyraźnie, że większa poprawa QoL nastąpiła przez pierwsze pół roku terapii.
Piśmiennictwo
1. Herman M., Fox-Rushby J., Badia X.; A model of equivalence in cultural adaptation of HRQoL instruments: the universalist approach; Qual. Life. Res. 1998:7, 323-335
2. Root A.W., Root M.J.; Clinical pharmacology of human growth hormone deficiency in children and adults; Endocr. Rev. 1998:19, 27-52
3. Greulich W.W., Pyle S.I.; Radiographic atlas of skeletal development of the hand and wrist. Stanford; California: Stanford University Press 1993
4. Kowalik S.; Pomiar jakości życia – kontrowersje teoretyczne. W: Pomiar poczucia jakości życia u aktywnych zawodowo oraz bezrobotnych. Pod red.: A. Bańki, R. Derbis (red.); Wyd. UAM i WSP Gemini Poznań 1995, 75-85
5. Hilczer M.; Niedobór wzrostu u dzieci – przyczyny, diagnostyka, leczenie. Nowoczesne metody leczenia niskorosłości i zaburzeń dojrzewania; Zjazd PTED Gdańsk 2008
6. Hilczer M., Lewiński A.; Wskazania do leczenia hormonem wzrostu u dzieci i dorosłych; Przegląd Pediatryczny 2004:34, 170-175
7. GH Research Society; Consensus guidelines for the diagnosis and treatment of growth hormone (GH) deficiency in childhood and adolescence: summary statement of the GH Research Society; J. Clin. Endocrinol. Metab. 2000:85, 3990-3993
8. Mersebach H., Rasmussen Ĺ.K., Feldt-Rasmussen U.; Body composition – methods and effects of growth hormone. W: Growth Hormone Deficiency in Adults: 10 Years of KIMS, R. Abs, U. Feldt-Rasmussen (eds); Oxford PharmaGenesis 2004, 117-126
9. Palczewska I., Szilagyi-Pągowska I.; ABC zabiegów diagnostycznych i leczniczych w pediatrii. Odcinek 17: Ocena rozwoju somatycznego dzieci i młodzieży; Med. Prakt. Pediat. 2002: 3, 140-169
10. Ross J.L., Sandberg D.E., Rose S.R. et al.; Psychological adaptation in children with idiopathic short stature treated with growth hormone or placebo; J. Clin. Endocrinol Metab. 2004:89(10), 4873-4878
11. Seikaly M.G., Warady B.A., Waber P., Stablein D.; The effect of rhGH on height velocity and BMI in children with CKD: a report of the NAPRTCS registry; Pediatr Nephrol. 2009 Apr 23
12. Cramer J.A. et al.; Brief report: a quality of life instrument for adolescents with growth disorders; Journal of Adolescence 2005:28, 4, 595-600
13. Kołtowska-Haggstrom M., Kind P.; Evaluating outcomes in adult growth hormone deficiency: the status of quality of life measurement in clinical studiem. ENDO 2003; The Endocrine Society 85th Annual Meeting Jun 19-2 Philadelphia, USA
14. McGauley G.A., Cuneo R.C., Salomon F.; Psychological well-beingbefore and after growth hormone treatment in adults with growth hormone deficiency; Hor. Res. 1990:33, 52-54
15. Adamska R.; Dziecko i jego rodzic w obliczu choroby przewlekłej – ocena jakości życia z astmą; Ped. Prakt. 2005:13, 1
16. Kojima M., Hosoda H., Date Y. et al.; Ghrelin is a growth-hormone-releasing acylated peptide from stomach; Nature 1999:408, 656-660
17. Mazur J., Mierzejewska E.; Jakość życia związana ze zdrowiem dzieci i młodzieży – koncepcje, metody badawcze i wybrane zastosowania; Med. Wieku Rozw. 2003:7, 35
18. Dattani M., Preece M.; Growth hormone deficiency and related disorders: insights into causation, diagnosis, and treatment; Lancet 2004:363, 1977-1987
19. Bryant J., Cave C., Mihaylova B. et al.; Clinical effectiveness and cost-effectiveness of growth hormone in children: a systematic review and economic evaluation; Health Technology Assessment 2002:6, 18, 15-55
20. ; Staff of the Benjamin Rose Hospital. Multidisciplinary study of illness in aged persons II; J. Chron. Dis. 1959:9(1), 55-62
21. Sheppard L, Eiser C., Davies H.A. et al.; The Effects of Growth Hormone Treatment on Health-Related Quality of Life in Children; Horm Res. 2006:30, 65(5), 243-249
22. ; Staff of the Benjamin Rose Hospital. Multidisciplinary study of illness in aged persons II; J. Chron Dis. 1959:9(1), 55-62
23. Blethen S.L., Allen D.B., Graves D.; Safety of recombinant deoxyribonucleic acid derived growth hormone: the National cooperative study experience; J. Clin. Endocrinol. Metab. 1996:81, 1704-1710
24. Drake W.M., Howell S.J., Monson J.P.; Optimizing GH therapy in adults and children; Endocr. Rev. 2001:22, 425-450
25. Raiti S.; The National hormone and pituitary program (NHPP) historical pespective. W: Pediatric endocrinology 1986 (Liber amicorum Andrea Prader). Red. R. Illig, H. Visser, Acta Endocr; Kopenhagen 1986, 66
26. Root A.W., Root M.J.; Clinical pharmacology of human growth hormone and its secretaggogues; Curr. Drug Targets Immune Endor. Metabol. Disord. 2002:2, 27-52
27. Romer T., Peter F., Saenger P. et al.; Efficacyand safety of a new ready-to-use recombinant human growth hormone solution; J. Endocrinol. Invest. 2007:30, 578-589
28. Takahashi Y., Kaji H., Okimura Y. et al.; Brief report: short stature caused by a mutant growth hormone; N. Engel. J. Med. 1996:334(7), 432-436
29. Dash R.J., Muralidharan R., Talwar V.; Growth hormone therapy; JAPI 1999:4, 417-425
30. Frasier S.; Abnormalities of growth. W: Pediatric endocrinology; Eds R. Collu, J. Ducharme, H. Guyda. 2nd ed.New York, Raven Press 1989, 171-215








