Endokrynol. Ped. 11/2012; 4(41):27-32
DOI: 10.18544/EP-01.11.04.1426
Lipoatrofia cukrzycowa – historia czy wciąż aktualny problem?
Klinika Endokrynologii Dzieci i Młodzieży, Katedra Pediatrii, Polsko-Amerykański Instytut Pediatrii, Uniwersytet Jagielloński Collegium Medicum
Słowa kluczowe: lipoatrofia, cukrzyca typu 1, insulina, dzieci i młodzież
Streszczenie
Lipoatrofia jest rzadkim (ok. 1,4 % dorosłych chorych z cukrzycą typu 1, DM1) powikłaniem insulinoterapii o niejasnej etiologii. Najczęściej ogniska lipoatrofii są wyraźnie odgraniczone i zlokalizowane w miejscach wstrzykiwania insuliny (lipoatrofia ograniczona), znacznie rzadziej w okolicach ciała oddalonych od miejsc wstrzykiwania (lipoatrofia wielomiejscowa). Celem pracy było określenie częstości występowania lipoatrofii cukrzycowej u dzieci i młodzieży z DM1, próba ustalenia czynników ryzyka oraz postępowania w przypadku jej wystąpienia. Materiał i metody. Analizie retrospektywnej poddano dokumentację medyczną 980 chorych z DM 1 w wieku 1–18 lat, pozostających pod opieką Poradni Cukrzycowej Uniwersyteckiego Szpitala Dziecięcego w Krakowie w latach 2010–2011. Wyniki i wnioski. Lipoatrofia występuje u ok. 1 % dzieci i młodzieży z DM1. Najczęściej występuje w postaci zlokalizowanej. Postać wielomiejscowa stanowi około 0,1-0,2% przypadków. Najczęstszą przyczyną lipoatrofii zlokalizowanej o łagodnym i umiarkowanym nasileniu jest niewłaściwa technika wstrzykiwania insuliny. W leczeniu skuteczna jest zmiana techniki wstrzyknięć, a w niektórych przypadkach zmiana preparatu insuliny. Przyczynami lipoatrofii wielomiejscowej mogą być współistniejące zakażenia (gruźlica) oraz zaburzenia funkcji układu odpornościowego. W tych przypadkach leczenie powinno być zindywidualizowane, a rokowanie jest niepewne
Wstęp
Lipoatrofia, czyli zanik podskórnej tkanki tłuszczowej, stanowi obecnie rzadkie, jednakże dotkliwe dla chorych oraz utrudniające prowadzenie skutecznego leczenia cukrzycy powikłanie insulinoterapii. W przeszłości, gdy w leczeniu cukrzycy typu 1 (DM1) powszechnie stosowano preparaty insulin zwierzęcych (wołowej i wieprzowej), lipoatrofia występowała aż u 55% chorych [1]. Wprowadzenie wysoko oczyszczonych oraz rekombinowanych preparatów insuliny spowodowało niemal całkowite jej wyeliminowanie, a pojedyncze przypadki pojawiły się wraz z rozpowszechnieniem nowoczesnych rekombinowanych analogów insuliny oraz insulinoterapii za pomocą ciągłego podskórnego wlewu insuliny pompą osobistą. Rzeczywista częstość występowania lipoatrofii pozostaje nieznana, jakkolwiek pojedyncze doniesienia szacują ją na około 1,4% [2]. Lipoatrofia cukrzycowa najczęściej ma charakter zlokalizowany, w postaci wyraźnie odgraniczonych pojedynczych lub mnogich ognisk zaniku podskórnej tkanki tłuszczowej w miejscach wstrzykiwania insuliny. Rzadko występuje jako postać wielomiejscowa z mniej wyraźnie odgraniczonymi zanikami, często także w tych okolicach ciała, w które nigdy nie podawano insuliny (klatka piersiowa, twarz). Patomechanizm powstawania lipoatrofii cukrzycowej jest nieznany. Przeważa hipoteza lokalnego zapalenia indukowanego antygenem egzogennej insuliny, mechanicznym uszkodzeniem adipocytów przez wielokrotnie potarzane wstrzyknięcia w to samo miejsce czy też urazem termicznym spowodowanym zbyt niską temperaturą roztworu insuliny. Według innej teorii podstawowe znaczenie ma nieprawidłowe różnicowanie komórek tkanki tłuszczowej, spowodowane zaburzeniem lokalnych i ogólnoustrojowych mechanizmów regulacyjnych u osób predysponowanych z wrodzonymi zaburzeniami układu odpornościowego, lub uczulenie na insulinę [3–5]. Rozważa się także współwystępowanie obu tych mechanizmów. Wobec braku szczegółowej wiedzy na temat przyczyn i mechanizmu powstawania lipoatrofii cukrzycowej dotychczas nie ustalono jednoznacznego sposobu postępowania diagnostycznego ani leczenia. W piśmiennictwie opisuje się ustąpienie zmian pod wpływem zmiany preparatu insuliny, sposobu jej podawania (wielokrotne wstrzyknięcia vs. ciągły podskórny wlew), leczenia glikokortykosteroidami, lekami stabilizującymi błony mastocytów (kromoglikan sodowy) oraz immunosupresyjnymi. Wszystkie te działania mają jednak charakter eksperymentalny i trudno przewidzieć ich skuteczność oraz ewentualne efekty niepożądane w poszczególnych przypadkach. Niezależnie od wyników leczenia w chwili obecnej nie można także jednoznacznie określić dalszego rokowania u chorych z lipoatrofią.
Cel
1. Analiza częstości występowania lipoatrofii cukrzycowej u dzieci i młodzieży z DM1 leczonych w Poradni Cukrzycowej Uniwersyteckiego Szpitala Dziecięcego.
2. Próba ustalenia czynników ryzyka lipoatrofii cukrzycowej w badanej grupie.
3. Określenie skuteczności różnych sposobów postępowania z pacjentami z lipoatrofią cukrzycową.
Materiał i metody
Analizie retrospektywnej poddano dokumentację medyczną 980 chorych z DM1 w wieku 1–18 lat pozostających pod opieką Poradni Cukrzycowej Uniwersyteckiego Szpitala Dziecięcego w Krakowie w latach 2010–2011. Analizowano: lokalizację i morfologię zmian lipoatroficznych, czas ich wystąpienia od momentu zachorowania, rodzaj insuliny oraz sposób jej podawania, współwystępowanie innych chorób.
Wyniki
Lipoatrofię cukrzycową stwierdzono u 10 (6 dziewcząt, 4 chłopców), tj. ok. 1% badanych. Średnia wieku w chwili wystąpienia lipoatrofii wynosiła 9,7 lat (zakres 6–17 lat). W badanej grupie 8 chorych było leczonych ciągłym podskórnym wlewem insuliny z zastosowaniem insuliny ludzkiej (Actrapid, NovoNordisk) (1 osoba) lub analogów insuliny aspart (Novorapid, NovoNordisk) (5 osób) i lispro (Humalog, Eli Lilly) (2 osoby). Dwóch chorych leczonych było metodą wielokrotnych wstrzyknięć w oparciu o bezszczytowy analog detemir (Levemir, NovoNordisk) podawany dwa razy na dobę oraz szybko działający analog aspart do posiłków (1 osoba) lub insulinę ludzką (Actrapid, NovoNordisk) podawaną przed śniadaniem i szybko działający analog aspart do pozostałych posiłków (1 osoba). Szczegółowe wyniki przedstawiono w tabeli 1.
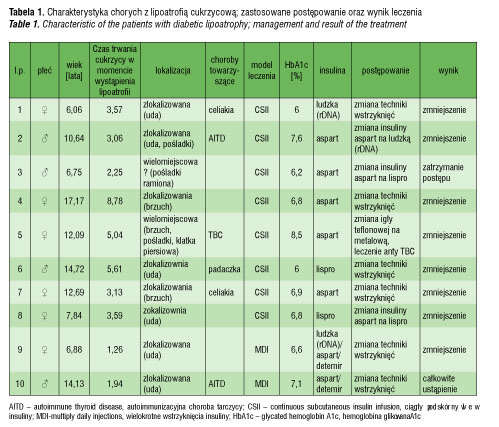
U 8 badanych stwierdzono lipoatrofię ograniczoną, u jednej chorej zmiany miały charakter wielomiejscowy. W jednym przypadku nie udało się jednoznacznie określić charakteru zmian, ponieważ ich morfologia była typowa dla lipoatrofii wielomiejscowej, ale lokalizacja wyłącznie w tych okolicach ciała, w które wstrzykiwano insulinę. Lipoatrofia wystąpiła po średnio 3,8 roku (zakres: 1,26-8,78) od zachorowania na DM1. W większości przypadków (6/10) lipoatrofia ustąpiła pod wpływem poprawy techniki wstrzyknięć insuliny – zakładania igły do ciągłego podskórnego wlewu insuliny w inne okolice ciała oraz ponownej edukacji chorych i ich rodziców w tym zakresie. W przypadku dwóch chorych leczonych metodą wielokrotnych wstrzyknięć insuliny lipoatrofia ograniczona wystąpiła wyłącznie w miejscach wstrzykiwania insuliny detemir.
W obu przypadkach skuteczne okazało się wstrzykiwanie małych porcji szybko działającego analogu insuliny (dawki korekcyjne) w obrzeża i okolice bezpośrednio sąsiadujące z miejscami zaniku tkanki podskórnej, w jednym przypadku dodatkową poprawę przyniosła zmiana sposobu leczenia na ciągły podskórny wlew insuliny. U dwu chorych z lipoatrofią ograniczoną stwierdzono współwystępowanie celiakii, u dwóch innych autoimmunizacyjnej choroby tarczycy, a u jednego padaczki.
U chorej z lipoatrofią wielomiejscową stwierdzono obecność przeciwciał przeciwjądrowych oraz zakażeniowy odczyn tuberkulinowy (19 mm). Badanie popłuczyn oskrzelowych jak również wyniki badań obrazowych (RTG oraz tomografia komputerowa płuc) nie potwierdziły jawnej gruźlicy, przeprowadzono zatem typową chemioprofilatykę z zastosowaniem izoniazydu i rifampicyny. Po jej zakończeniu do leczenia włączono metotreksat. Zmieniono też rodzaj igły do ciągłego podskórnego wlewu insuliny z teflonowej na metalową. W następstwie tych działań uzyskano początkowo zahamowanie progresji zmian, a następnie stopniowe wypełnianie się ubytków tkanki podskórnej.
Dyskusja
Lipoatrofia w przebiegu DM1 stanowi rzadkie, jakkolwiek trudne diagnostycznie i pogarszające wyniki leczenia powikłanie insulinoterapii o niepewnym rokowaniu. Dotychczas jej występowanie stwierdzano najczęściej, podobnie jak w przedstawionym materiale własnym, u chorych leczonych analogami insuliny: aspart [6], lispro [7–9], glargina [9] i detemir [6], jakkolwiek istnieją także dobrze udokumentowane przypadki lipoatrofii u osób leczonych preparatami insuliny ludzkiej [4,10,11]. Znaczenie sposobu podawania insuliny (wielokrotne wstrzyknięcia vs. ciągły podskórny wlew) w powstawanie lipoatrofii jest nadal kontrowersyjne. Chociaż istnieją doniesienia o pojawieniu się zaników tkanki tłuszczowej w okolicach cewnika po wprowadzeniu insulinoterapii ciągłym podskórnym wlewem [7,9], co wykazano również w materiale własnym (8 na 10 chorych było leczonych osobistą pompą insulinową), to jednak wielu autorów wskazuje na ochronny czy nawet leczniczy wpływ podawania insuliny tą metodą i zaleca jej stosowanie z wyboru u chorych z lipoatrofią [14]. U jednego z prezentowanych chorych także wprowadzono tę metodę insulinoterapii, nie stwierdzając występowania nowych ognisk zaniku tkanki tłuszczowej.
Trudności diagnostyczne i brak możliwości określenia czynników ryzyka lipoatrofii wynikają przede wszystkim z niedostatecznego poznania mechanizmu jej powstawania. W odniesieniu do postaci zlokalizowanej najczęściej sugeruje się dominujące znaczenie egzogennej insuliny jako antygenu inicjującego proces zapalny. Wskazują na to wyniki badań histopatologicznych, potwierdzające obecność podwyższonego stężenia cytokin prozapalnych, głównie TNF alfa, złogów IgM, składników komplementu oraz fibrynogenu w materiale pobranym z ognisk lipoatrofii. Prawdopodobnie to lokalne zapalenie jest przyczyną nieprawidłowego różnicowania się adipocytów, nasilenia apoptozy, a w konsekwencji zaniku tkanki tłuszczowej. W niektórych przypadkach o szczególnie ciężkim przebiegu istotne znaczenie wydaje się mieć także współwystępowanie z cukrzycą wrodzonych zaburzeń regulacji odpowiedzi immunologicznej lub uczulenia na insulinę [4]. W przedstawionym materiale w żadnym przypadku nie stwierdzono jednak zaburzeń odporności. Tylko u dwu chorych współwystępowała choroba Hashimoto, a u swu innych celiakia, co nie pozwala na jednoznaczne stwierdzenie ich znaczenia jako czynników ryzyka wystąpienia lipoatrofii.
W badanej grupie u sześciu chorych z najmniej nasilonymi zanikami skuteczna okazała się zmiana techniki wstrzykiwania insuliny/zmiana miejsca zakładania cewnika do ciągłego podskórnego wlewu insuliny i dodatkowa edukacja w tym zakresie. Wskazuje to jednoznacznie, że przynajmniej część przypadków łagodnej lipoatrofii jest spowodowana urazem mechanicznym lub termicznym, inicjującym rozwój lokalnego stanu zapalnego. Można zatem jej zapobiegać przez odpowiednią edukację chorych. W pozostałych przypadkach, w których zmiany utrzymywały się pomimo takiego postępowania, zmieniono preparaty insuliny, a w jednym przypadku także sposób jej podawania z modelu wielokrotnych wstrzyknięć na ciągły podskórny wlew insuliny. Znaczną poprawę uzyskano we wszystkich poza jednym przypadkiem, w którym morfologia zaników odpowiadała co prawda lipoatrofii wielomiejscowej, ale jej ogniska były zlokalizowane wyłącznie w miejscach wstrzykiwania insuliny. Wskazuje to na bardziej złożony mechanizm powstawania zaników tkanki tłuszczowej, jak w lipoatrofii wielomiejscowej, którą jednoznacznie rozpoznano u jednej chorej w badanej grupie. Obecnie uważa się, że w odróżnieniu od postaci zlokalizowanej lipoatrofia wielomiejscowa jest spowodowana nie tylko podawaniem egzogennej insuliny, ale także współwystępowaniem innych czynników predysponujących. Pod uwagę brane są przede wszystkim choroby infekcyjne, głównie takie, które w znaczący sposób wpływają na regulację mechanizmów obronnych organizmu. Należą do nich zakażenia Mycobacterium tuberculosis oraz HIV. Nie można również wykluczyć udziału czynników związanych z autoimmunizacją i układowymi chorobami tkanki łącznej [3,13]. W przedstawionym przypadku rozpoznano gruźlicę latentną i zastosowano standardową chemioprofilaktykę, a następnie przeprowadzono leczenie metotreksatem. W wyniku takiego postępowania uzyskano oczekiwany skutek w postaci zatrzymania postępu zaniku tkanki tłuszczowej, a następnie stopniowego wypełniania się jej ubytków. Nie można jednak jednoznacznie określić, który z elementów zastosowanego leczenia miał istotniejsze znaczenie ani jaki był czynnik bezpośrednio inicjujący powstanie tak rozległej lipoatrofii u opisywanej chorej.
Wnioski
1. Lipoatrofia jest rzadkim powikłaniem insulinoterapii i dotyczy ok. 1 % dzieci i młodzieży z DM1. Najczęściej występuje w postaci zlokalizowanej. Postać wielomiejscowa występuje u około 0,1–0,2% przypadków dzieci i młodzieży z DM1.
2. Najczęstszą przyczyną lipoatrofii zlokalizowanej o łagodnym i umiarkowanym nasileniu jest niewłaściwa technika wstrzykiwania insuliny i/lub alergia na insulinę, materiał z którego wykonano igły/cewniki do ciągłego podskórnego wlewu insuliny. W leczeniu skuteczna jest zmiana techniki wstrzyknięć, a w niektórych przypadkach konieczna jest także zmiana preparatu insuliny.
3. Przyczynami lipoatrofii wielomiejscowej mogą być współistniejące zakażenia (np. gruźlica) oraz zaburzenia funkcji układu odpornościowego. W tych przypadkach leczenie powinno być zindywidualizowane.
Piśmiennictwo
1. Paley R.G.; Lipodystrphy following insulin injections; Metabolism 1953:2, 201-210
2. Hajheydari Z., Kashi Z., Akha O., Akbarzadeh S.; Frequency of lipodystrophy induced by recombinant human insulin; Eur. Rev. Med. Pharmacol. Sci. 2011:15, 1196-1201
3. Radermecker R.P., Pierard G.E., Scheen A.J.; Lipodystrophy reactions to insulin, effects of continuous insulin infusion and new insulin analogs; Am. J. Clin. Dermatol. 2007:8, 21-28
4. Beltrand J., Guilmin-Crepon S., Castanet M. et al.; Insulin allergy and extensive lipoatrophy in child with type 1 diabetes; Horm. res. 2006:65, 253-260
5. Lopez X., Castells M., Ricker A. et al.; Human Insulin Analog–Induced Lipoatrophy; Diabetes Care. 2008:31, 442-444
6. Babiker A., Datta V.; Lipoatrophy with insulin analogues in type 1 diaberes; Arch. Dis. Child. 2011:96, 101-102
7. Griffin M.E., Feder A., Tamborlane W.V.; Lipoatrophy associated with lispro insulin in insulin pump therapy: an old complication, a new cause?; Diabbetes Care 2001:24, 174
8. Arranz A., Andia V., López-Guzmán A.; A case of lipoatrophy with Lispro insulin without insulin pump therapy; Diabetes Care 2004:27, 625-626
9. Ampudia-Blasco F.J., Hasbum B., Carmena R.; A new case of lipoatrophy with lispro insulin in insulin pump therapy is there any insulin preparation free of complications?; Diabetes Care 2003:26, 953-954
10. Murao S., Hirata K., Ishida T. et al.; Lipoatrophy induced by recombinant human insulin injection; Intern. Med. 1998:37, 1031-1033
11. Ramos A.J.S., Farias M.A.; Human insulin-induced lipoatrophy A successful treatment with glucocorticoid; Diabetes Care 2006:29, 926-927
12. Ampudia-Blasco F.J., Girbes J., Carmena J.; A case of lipoatrophywith insulin glargine: long acting insulin analogs are not exempt from this complication; Diabetes Care 2005:28, 2983
13. Atlan-Gepner C., Bongrand P., Farnarier C. et al.; Insulin-induced lipoatrophy in type 1 diabetes. A possible tumor necrosis factor-alpha-mediated dedifferentiation of adipocytes; Diabetes Care 1996:19, 1283-1285
14. Chantelau E., Reuter M., Schotes S. et al.; Severe lipoatrophy with human insulin: successfully treated by CSII; Diabet. Med. 1993:10, 580-581








