Endokrynol. Ped. 10/2011;4(37):69-74
DOI: 10.18544/EP-01.10.04.1366
Choroba Gravesa–Basedowa u noworodka – trudności diagnostyczne
1Katedra i Klinika Endokrynologii i Diabetologii Wieku Rozwojowego AM we Wrocławiu
2Samodzielny Publiczny Szpital Kliniczny nr 1 we Wrocławiu
Słowa kluczowe: choroba Graves–Basedowa, noworodek, ciąża, tarczyca
Streszczenie
Choroba Gravesa i Basedowa noworodków powstaje w wyniku przechodzenia przez łożysko immunoglobulin stymulujących gruczoł tarczowy płodu. Zarówno u matki, jak i u noworodka stwierdza się obecność TRAb w surowicy krwi. Eutyreoza czy hypotyreoza u matki nie wyklucza wystąpienia objawów nadczynności tarczycy u noworodka. Większą skłonność do wystąpienia nadczynności tarczycy wykazują wcześniaki. Charakterystycznymi objawami nadczynności tarczycy u noworodków są: częstoskurcz ok. 200 uderzeń na minutę, zaburzenia oddychania, znaczny niepokój dziecka, często wytrzeszcz i niewielkiego stopnia wole. Czasem symptomatologia nie jest pełna i sugeruje zaburzenia o innym podłożu
Wstęp
Tyreotoksykoza noworodków jest rzadkim schorzeniem zagrażającym życiu (śmiertelność 12–25%) oraz odległymi następstwami [1, 2].
Płodowa postać choroby Gravesa–Basedowa jest konsekwencją przenikania przeciwciał przeciwko receptorowi dla TSH (TRAb, TSH-receptor antibodies) przez łożysko z organizmu matki do płodu w okresie, w którym tarczycę płodu charakteryzuje już wykształcona funkcja hormonalna [2, 3]. Ryzyko wystąpienia choroby Gravesa–Basedowa u płodu i noworodka jest szczególnie duże wówczas, kiedy miano tych przeciwciał przekracza ponadpięciokrotnie górną granicę normy [4]. Przedstawiony mechanizm przezłożyskowego transferu przeciwciał stymulujących tarczycę wyjaśnia, dlaczego postać płodowa nadczynności choroby Graves–Basedowa może być stwierdzana u potomstwa kobiet poddanych leczeniu chirurgicznemu lub leczeniu jodem radioaktywnym, będących w fazie hipotyreozy i otrzymujących substytucję L-tyroksyną. Obie formy terapii, choć przywracają hormonalną równowagę tarczycy, nie zapobiegają powstaniu przeciwciał.
Za rozpoznaniem płodowej nadczynności tarczycy przemawiają: tachykardia płodu (powyżej 160 uderzeń/min.), wewnątrzmaciczne zahamowanie wzrostu, przyspieszone dojrzewanie szkieletu oraz przedwczesne zarośnięcie szwów czaszki [5].
Noworodkowa postać nadczynności tarczycy jest obserwowana u poniżej 1% dzieci kobiet z chorobą Gravesa–Basedowa (1:50 000 noworodków) [6]. Jej patomechanizm w ogromnej większości jest podobny do patogenezy płodowej postaci choroby Graves–Basedowa i wynika z transferu przezłożyskowego przeciwciał TRAb od matki do płodu. Szczególnie duże zagrożenie dotyczy dzieci matek, u których stężenie przeciwciał TRAb w trzecim trymestrze ciąży jest wysokie [3, 6].
Opis przypadku
Noworodek płci męskiej ur. z CII (powikłanej zagrażającym porodem przedwczesnym, infekcjami dróg moczowych i pochwy oraz niedoczynnością tarczycy u matki), PII przedwczesnego (37 hbd), rozwiązanego cięciem cesarskim z powodu ułożenia twarzyczkowego, zielonych wód płodowych. Masa ciała po urodzeniu 2600 g, dł. 49 cm, z 6 punktami w skali Agar. Po urodzeniu cechy hipotrofii, masywny obrzęk twarzoczaszki z wynaczynieniami i otarciami naskórka na policzkach. Obserwowano również odgięciowe ułożenie głowy oraz tachykardię.
Matka lat 34 leczona od 15. roku życia z powodu nadczynności tarczycy powikłanej licznymi nawrotami wynikającymi z braku kontroli, jak też nieregularnego przyjmowania leków. Podczas ciąży u matki stwierdzono niedoczynność tarczycy i zastosowano leczenie L-tyroksyną w dawce 75 µg/dobę.
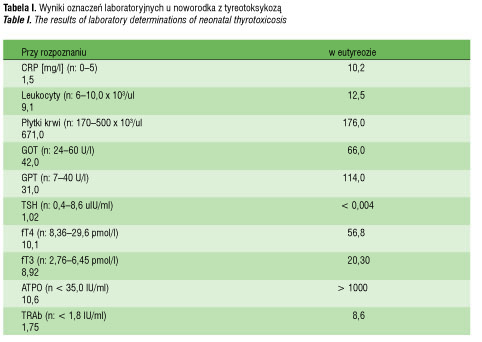
Noworodek w drugiej dobie życia przekazany został do Oddziału Patologii Noworodka w stanie ogólnym średnim (tachykardia, niepokój, dyskretne zaburzenia w oddychaniu, na twarzy liczne podbiegnięcia krwawe). Umieszczono go w inkubatorze, monitorowano parametry życiowe. Obraz kliniczny oraz wyniki badań dodatkowych (tab. I) sugerowały zakażenie wewnątrzmaciczne o nieznanej etiologii. Na podstawie rtg klatki piersiowej rozpoznano zapalenie płuc. Wykluczono zapalenie opon mózgowo-rdzeniowych. Zastosowano leczenie objawowe (nawadnianie pozajelitowe, tlenoterapię Digoxin) oraz antybiotykoterapię. W 12. dobie życia z powodu utrzymującego się pobudzenia, wzmożonej potliwości, hipertermii oraz nasilającej się tachykardii rozszerzono diagnostykę w kierunku zaburzeń funkcji tarczycy. Stwierdzono obniżone stężenie TSH 0,026 µIU/ml (norma: 0,4–8,6 uIU/ml), wysokie stężenie fT4 56,8 pmol/l (norma: 8,36–29,6 pmol/l) i fT3 20,3 pmol/l (norma: 2,76–6,45 pmol/l) oraz wysokie miana przeciwciał anty TPO > 1000,0 IU/ml (norma poniżej 35,0 IU/ml), anty Tg > 1000,0 IU/ml (norma do 40,0 IU/ml), przeciw receptorowi TSH (TRAb) 8,6 IU/ml (norma do 1,8 IU/ml). Do terapii włączono Metizol 1 mg/kg mc, płyn Lugola 3 x 1 kropla, Propranolol 3 x 1 mg. Od drugiej doby leczenia obserwowano stopniową poprawę stanu ogólnego, normalizację akcji serca oraz stężeń hormonów tarczycy w surowicy krwi. Leczenie Metizolem i Propranololem kontynuowano w dawkach stopniowo redukowanych, aż do odstawienia po 24. dobach leczenia (TSH 0,251 mIU/ml, fT4 8,07 pmol/l, fT3 6,96 pmol/l, TRAb 1,75 IU/ml).
U chłopca w trzecim tygodniu po odstawieniu Metizolu obserwowano przejściową hipotyreozę (fT4 7,07 uIU/ml), włączono więc L-tyroksynę w dawce 12,5 ug/dobę. Leczenie to odstawiono po ukończeniu przez pacjenta 12. miesiąca życia z powodu całkowitej normalizacji TSH i fT4.
Obecnie prawie 2-letni chłopczyk pozostaje po kontrolą endokrynologiczną. Ocena auksologiczna oraz tyreologiczna nie wykazuje odchyleń od normy.
Dyskusja
Choroby tarczycy występują u kobiet od czterech do pięciu razy częściej niż u mężczyzn, zwłaszcza w okresie rozrodczym. Szacuje się, że zaburzenia funkcji tarczycy (tyreotoksykoza ciężarnych, autoimmunologiczne zapalenia tarczycy, subkliniczna niedoczynność tarczycy) występują u 5–15% kobiet w ciąży, a nadczynność (z wyłączeniem hipertyreozy ciężarnych) u 0,1–0,4% [7, 8].
Noworodkowa postać nadczynności tarczycy jest obserwowana u poniżej 1% dzieci kobiet z chorobą Gravesa–Basedowa. Jej patomechanizm wynika z przedostawania się przeciwciał przeciw receptorowi dla TSH przez barierę łożyskową [9]. Szczególnie duże zagrożenie powstaniem tej postaci nadczynności tarczycy dotyczy dzieci matek z wysokim stężeniem przeciwciał TRAb w trzecim trymestrze ciąży [3, 6]. Znane są również pojedyncze przypadki, w których podłożem noworodkowej postaci nadczynności tarczycy jest aktywująca
mutacja receptora dla TSH oraz zespół McCune–Albrighta [2, 5, 10].
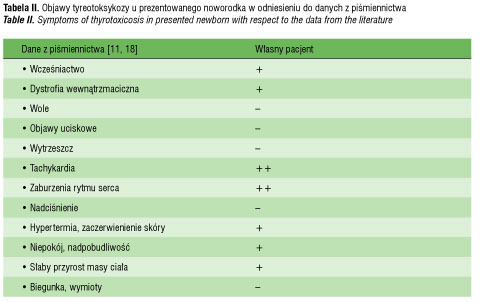
Objawy nadmiaru hormonów tarczycy u noworodków na ogół występują zaraz po urodzeniu, a opóźnienie występowania noworodkowej tyreotoksykozy może być związane bądź z otrzymywaniem przez matkę tyreostatyków, bądź na skutek obecności w krwiobiegu dziecka TRAb o charakterze blokującym (TRAb, TSH – teceptor-blocking antibodies). Najczęściej objawy pojawiają się w pierwszych dziesięciu dniach życia, typowe dla tyreotoksykozy są wole, wytrzeszcz, tachykardia. Czasami jednak, jak w prezentowanym przypadku, przebieg tyreotoksykozy u noworodka może mieć odmienny obraz, co zwłaszcza przy braku informacji o chorobie tarczycy u matki (wywiad położniczy) może sprawiać trudności diagnostyczne i opóźniać rozpoznanie i leczenie [1, 11, 12]. Objawy kliniczne obserwowane u opisywanego noworodka, w odniesieniu do danych z piśmiennictwa systematyzujących objawy tyreotoksykozy według częstości występowania, przedstawiono w tabeli II.
U płodów matek z chorobą Graves–Basedowa stężenia TRAb pozostają niskie do 15. tygodnia ciąży, następnie wzrastają progresywnie, osiągając ok. 30. tygodnia ciąży stężenie równe matczynemu. Tyreotoksykoza płodowa rozwija się w trzecim trymestrze ciąży, kiedy choroba Graves–Basedowa u ciężarnych znajduje się zwykle w remisji, zaś u matki opisywanego noworodka stwierdzono hipotyreozę. Brak szczegółowego wywiadu dotyczącego przebytych chorób tarczycy matki, niepowiązanie jej choroby tarczycy z objawami występującymi u noworodka oraz ich nietypowy obraz kliniczny – to przyczyny opóźnienia rozpoznania tyreotoksykozy u dziecka. Z podobnymi trudnościami diagnostycznymi spotkali się również inni autorzy [1, 11, 13, 14, 18].
W ogromnej większości przypadków noworodkowa postać choroby Graves–Basedowa ma charakter przejściowy i utrzymuje się do momentu zniknięcia przeciwciał przeciwko receptorowi dla TSH, zwykle nie dłużej niż 8–20 tygodni [7, 10]. W łagodnych przypadkach schorzenie nie wymaga leczenia. Przy bardziej nasilonych objawach wskazane jest włączenie tyreostatyku i leku ß-adrenolitycznego [2]. Najczęściej podaje się tyreostatyk Metimazol w dawce 1 mg/kg m.c., który hamuje syntezę hormonów tarczycy, oraz ß-adrenolityk (Propranolol) w celu zminimalizowania hiperadrenergicznych skutków działania hormonów tarczycy na tkanki obwodowe jak również hamowania obwodowej konwersji tyroksyny (T4) do trijodotyroniny (T3). Początkowo Propranolol można podawać dożylnie w dawce 0,1 mg/kg, a następnie doustnie w dawce 1 mg/kg pod kontrolą glikemii i częstości akcji serca. W cięższych przypadkach i w początkowym okresie terapii podaje się roztwór (5%) Lugola w celu hamowania proteolizy koloidu i uwalniania do krwiobiegu już wytworzonych i zmagazynowanych w tarczycy hormonów. Ważne jest podanie preparatu jodu po pierwszej dawce tyreostatyku z uwagi na fakt nasilenia się syntezy hormonów tarczycy, a tym samym pogłębienia tyreotoksykozy [15]. W najcięższych przypadkach (przedprzełomowych i przełomowych) podaje się glikokortykosteroidy – hydrokortyzon, który nie tylko hamuje biotransformację T4 do T3, ale zapobiega także skutkom szybkiej degradacji kortyzolu przez nadmiar hormonów tarczycy (względna niewydolność nadnerczy) [10, 16].
Podsumowanie
Przedstawiony przypadek wskazuje na konieczność dostrzegania związku przyczynowego między stanem klinicznym płodu i noworodka a obecną czy przebytą chorobą matki. Eutyreoza czy hipotyreoza u matki nie wyklucza wystąpienia objawów nadczynności tarczycy u płodu i noworodka. Rekomendacje dotyczące postępowania u noworodków o wysokim ryzyku tyreotoksykozy obejmują ocenę kliniczną i pomiar stężeń fT4 i TSH w krwi pępowinowej oraz 2-krotne powtórzenie tych oznaczeń po 2–7 oraz 10–14 dobie po urodzeniu [17, 18].
Piśmiennictwo
1. Kalicka-Kasperczyk A., Starzyk J., Mitkowska Z. et al.; Stany zagrażające życiu noworodka a tyreotoksykoza – opis przypadku; Endokrynologia, Otyłość i Zaburzenia Przemiany Materii 2009:5, 1, 40-44
2. Polak M., Legac I., Vuillard E. et al.; Fetal and neonatal thyroid function in relation to Materna Graves’ disease; Best Pract. Res. Clin. Endocrinol. Metab. 2004:18, 289-302
3. Weetman A.P.; Graves’ disease; N. Engl. J. Med. 2000:343, 1236-1248
4. Lazarus J.H.; Thyroid diseases in relation to pregnancy: a decade ofchange; Clin. Endocrinol. 2000:53, 265-278
5. Lazarus J.H.; Thyroid diseases in pregnancy and childchood; Minerva Endocrinol. 2005:30, 71-87
6. Mestman J.H.; Hyperthyroidism in pregnancy; Best Pract. Res. Clin. Endocrinol. Metab. 2004:18, 267-288
7. Koutras D.A.; Thyroidoparies; Ann. N.Y. Acad. Sci. 2000:900, 77-88
8. Redmond G.P.; Thyroid dysfunction and women’s reproductive heakth; Thyroid 2004:14 suppl. 1, 5-15
9. Mestman J.H.; Hyperthyroidism in pregnancy; Endocrinol. Metab. Clin. North Am. 1998:27, 127-149
10. Zimmerman D.; Fetal and neonatal hyperthyroidism; Thyroid 1999:9, 727-733
11. Baerukhim R.S., Moon T.D., Felner E.I.; Neonatal thyrotoxicisis and conjugated hyperbilirubinemia; J. Matern. Fetal. Naenata. Med. 2003:13, 426-428
12. Caroll D.N., Kamath P., Stewart I.; Congenital viral infection?; Lancet 2005:365, 1110
13. Smith C.M., Gavranich J., Cotterill A. et al.; Congenital neonatal thyrotoxicosis and previous maternal radioiodine therapy; BMJ 2000:320, 1260-1261
14. Krüger C., Dörr H.G., Zant M. et al.; Neonatale hyperthyreose bei unbehandeltem maternalen M. Basedow – ein Fallberichtmit Literaturvergleich [w:] Reinwein D., Weinheimer B. (red.) Therapie der Hyperthyreose; De Gruyter Berlin 1994, 283-293
15. Duprez L., Parma J., Van Sande J. et al.; Germline mutations in the thyrotropin receptor gene cause non-autoimmune autosomal dominant hyperthyroidism; Nat. Genet. 1994:7, 369-401
16. Wartofsky L.; Thyrotoxic storm [w]: Wass J.A., Shalet S.M. (red.) Oxford textbook of endocrinology and diabetes; Oxford University Press New York 2002, 481-486
17. Horsley J., Ogilvy-Stuart A.L.; The infant of the mother with thyroid disease; Pediatr. Child. Healthm 2007:17; 228-232
18. Polak M., Legac I., Vuillard E. et al.; Congenital hyperthyroidism: The fetus as a patent; Horm. Res. 2006:65, 235-242








